
分析 (1)根据n=cv计算溶质Na2CO3的物质的量,利用Na2CO3•10H2O的物质的量等于Na2CO3的物质的量,根据m=nM计算Na2CO3•10H2O的质量;配制0.2mol/L的Na2CO3溶液480mL,应选择500mL容量瓶,实际配制500mL溶液;定容时加蒸馏水到离刻度线1-2cm时,改用胶头滴管逐滴滴加;
(2)依据配制一定物质的量浓度溶液的一般步骤排序;
(3)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断;
(4)容量瓶不能稀释浓溶液、不能用于溶解固体、储存溶液,不能用来测量溶液的体积等;
解答 解:(1)实验室需要0.2mol/L的Na2CO3溶液480mL,由于容量瓶的规格没有480mL,只能用500mL容量瓶,则500mLNa2CO3溶液需要Na2CO3的物质的量为:0.5L×0.2mol/L=0.1mol,Na2CO3•10H2O的物质的量为0.1mol,Na2CO3•10H2O的质量为:0.1mol×286g/mol=28.6g,
配制0.2mol/L的Na2CO3溶液480mL,应选择500mL容量瓶,实际配制500mL溶液;
定容时加蒸馏水到离刻度线1-2cm时,改用胶头滴管逐滴滴加;
故答案为:②28.6; ③500mL; ⑦胶头滴管;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,所以正确的操作顺序为:②⑥③⑧①⑨⑦④⑤;
故答案为:B;
(3)①Na2CO3•10H2O晶体准确称量后,失去了部分结晶水再溶解,对碳酸钠溶质的物质的量无影响,溶液浓度无影响;
②容量瓶未干燥用来配制溶液,对溶液物质的量和溶液体积都不产生影响,溶液浓度不受影响;
③转移溶液后,未洗涤烧杯和玻璃棒,导致溶质是物质的量偏小,溶液浓度偏低;
④定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低;
⑤定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
⑥溶解固体后,未等溶液冷却至室温立即转移到容量瓶定容,冷却后溶液体积偏小,溶液浓度偏高;
引起所配溶液浓度偏高的有⑤⑥,偏低的有③④,无影响的有①②.
故答案为:⑤⑥;③④;①②;
(4)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选BCD.
点评 本题主要考查一定物质的量浓度溶液的配制与稀释,注意容量瓶、量筒规格的选取方法为易错点,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
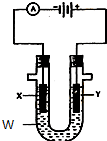 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液w;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应中的能量变化,通常表现为热量的变化 | |
| B. | 反应物的总能量高于生成物的总能量时发生放热反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl的反应是吸热反应 | |
| D. | 一氧化碳在氧气中的燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | Na2Ca | C. | Si02 | D. | CaC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3的分解率为20% | B. | 10分钟内ν(SO2)=0.01mol/(L•min) | ||
| C. | 容器内气体的密度为40g/L | D. | 此温度下反应①的平衡常数为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com