
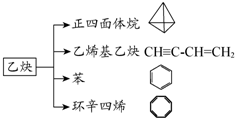
 乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题:
乙炔是一种重要的有机合成原料,以乙炔为原料在不同的反应条件下可以转化成如图所示的各种有机化合物.请回答下列问题: -CH=CH2、
-CH=CH2、 的反应为取代反应
的反应为取代反应分析 (1)①乙烯基乙炔分子碳碳双键、三键;
②正四面体烷含4个C、4个H;
③与环辛四烯互为同分异构体的分子式为C8H8,结构不同;
④CH≡CH生成 ,产物只有一种;
,产物只有一种;
(2)乙炔为原料在一定条件下制备环辛四烯时碳碳双键转化为双键,环辛四稀在一定条件下与足量的氢气反应时双键转化为单键,结合对称性分析取代产物;
(3)光照下发生取代反应,正四面体烷只有一种H.
解答 解:(1)①乙烯基乙炔分子碳碳双键、三键,含两种官能团,故正确;
②正四面体烷含4个C、4个H,分子式为C4H4,故正确;
③与环辛四烯互为同分异构体的分子式为C8H8,结构不同,分子为苯乙烯,故正确;
④CH≡CH生成 ,产物只有一种,不是取代反应,故错误;
,产物只有一种,不是取代反应,故错误;
故答案为:①②③;
(2)乙炔为原料在一定条件下制备环辛四烯时碳碳双键转化为双键,该反应为加成反应,环辛四稀在一定条件下与足量的氢气反应时双键转化为单键,反应为加成反应,生成环辛烷结构对称,只有一种H,则二硝基取代产物共有4 种,故答案为:加成反应;加成反应; 环辛烷;4;
(3)正四面体烷在光照条件下能与氯气发生取代反应,正四面体烷只有一种H,生成的一氯、二氯、三氯、四氯代产物的种数分别为一种、一种、一种、一种,
故答案为:取代反应; 一种;一种;一种;一种.
点评 本题考查有机物的结构与性质,为高频考点,把握烯烃、炔烃的性质及有机反应为解答的关键,侧重分析与应用能力的考查,注意结合对称性判断取代产物,题目难度中等.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾可以净水:Al3++3H2O=Al(OH)3(胶体)↓+3H+ | |
| B. | 少量小苏打溶液滴入Ba(OH)2溶液中:HCO-3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫氢化钠发生水解:HS-+H2O?H3O++S2- | |
| D. | 氧化亚铁加入稀硝酸:FeO+2H+=Fe2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
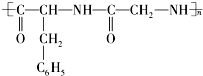 的单体是( )
的单体是( )| A. | ①③ | B. | ③④ | C. | ②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
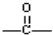
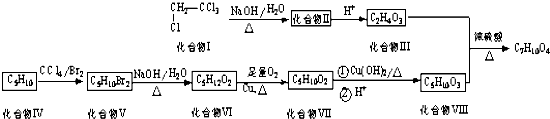
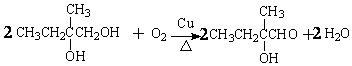 .
.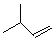 ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为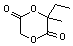 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol丙烷分子中,含有的非极性共价键数目为NA | |
| B. | 标准状况下,1.8gH2O分子中所含有的电子数为NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| D. | 2.24L 氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
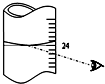 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
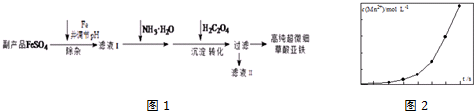
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com