
| A、摩尔是国际科学界建议采用的一种物理量 |
| B、32g O2中所含氧原子数为NA个 |
| C、1mol氧约含6.02×1023个O2 |
| D、摩尔是物质的量的单位,简称摩,符号为mol |


科目:高中化学 来源: 题型:
A、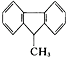 分子中的所有碳原子不可能同时在一个平面内 分子中的所有碳原子不可能同时在一个平面内 |
B、按系统命名法,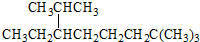 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 |
C、目前市场上大量矿泉水、食用油等产品包装瓶几乎都是用PET(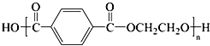 )的合成单体之一是对苯二甲酸 )的合成单体之一是对苯二甲酸 |
| D、有一种信息素的结构简式为CH3(CH2)5CH═CH(CH2)9CHO,为验证该物质中既含有醛基又含有碳碳双键,向该物质的试液中先加过量的溴水溶液,观察到溶液褪色,再向溶液中加入新制的Cu(OH)2悬浊液,加热煮沸,观察到砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠比水轻但比煤油重 |
| B、钠的熔点较低 |
| C、钠与水反应时要放出热量 |
| D、钠与水反应后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、③⑥ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 | B、11 | C、12 | D、13 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2O2所含的阴离子数目为2NA |
| B、在熔融状态下,lmol KHSO4完全电离出的阳离子数目为2NA |
| C、14g乙烯和丙烯的混和气体中共含有3NA对共用电子对 |
| D、将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com