
| A. | x<y | B. | x=y | C. | x>y | D. | 无法确定 |
分析 假设再次通入的NO2是在与原平衡体系的温度和压强都相同的另一容器中进行,则所得平衡体系与原平衡等效,将两个容器的隔板抽去,平衡不移动,以此解答.
解答 解:在一个容积可变的容器中通入气体,为了保持压强的一定,容器的体积必然会膨胀,假设,在题给的过程中,容器的体积从A变化到A+B(见图). 这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,再在B中充入1mol NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等,这时,抽去虚拟的隔板,A、B中的气体仅简单的混合,并不会发生平衡的移动.也就是说,在题给的过程中,NO2转化率不变,所以x=y,故选B.
这个过程也可以理解成:假设有一个虚拟的隔板可以保持A的体积不变,再在B中充入1mol NO2,使其反应直至达到平衡.很明显,在同温、同压下,A、B中达到平衡后,NO2、N2O4的质量分数分别相等,这时,抽去虚拟的隔板,A、B中的气体仅简单的混合,并不会发生平衡的移动.也就是说,在题给的过程中,NO2转化率不变,所以x=y,故选B.
点评 本题考查化学平衡的移动,题目难度不大,注意从压强的角度认识该题,题给的关键是反应物和生成物只有一种,注意体会该题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 正极的电极反应为Ag2S-2e-═2Ag++S | |
| C. | 该过程中铝是负极,发生氧化反应 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
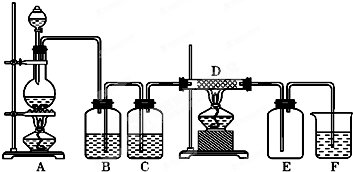 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
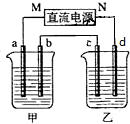 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com