
| A. | Na+、Al3+、Cl-、OH-(5:2:7:4) | B. | NH4+、Ba2+、OH-、Cl-(1:1:1:2) | ||
| C. | Fe3+、Na+、Cl-、S2-(1:2:3:1) | D. | K+、H+、I-、HCO3-(1:1:1:1) |
分析 A、Al3+与OH-之比为2:4,OH-不足,生成Al(OH)3沉淀;
B、NH4+、Ba2+、OH-、Cl-(1:1:1:2)能大量共存,可看做氯化钡和氨水的混合溶液;
C、Fe3+与S2-发生氧化还原反应;
D、H+与HCO3-反应放出CO2,溶液呈中性.
解答 解:A、Al3+与OH-之比为2:4,OH-不足,生成Al(OH)3沉淀,故A错误;
B、NH4+、Ba2+、OH-、Cl-(1:1:1:2)能大量共存,可看做氯化钡和氨水的混合溶液,呈碱性,故B正确;
C、Fe3+与S2-发生氧化还原反应,生成淡黄色的硫单质,故C错误;
D、H+与HCO3-反应放出CO2,溶液呈中性,故D错误;
故选B.
点评 本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握题目要求以及常见离子的性质和反应类型的判断,答题时注意题给信息,难度不大.


科目:高中化学 来源: 题型:解答题
试管编号 实验步骤 | 1 | 2 | 3 | 4 |
| 1%NaCl溶液(mL) | 1 | |||
| 1% CuSO4溶液(mL) | 1 | |||
| 1% Na2SO4溶液(mL) | 1 | |||
| 蒸馏水(mL) | 1 | |||
| pH6.8缓冲液(mL) | 1 | 1 | 1 | 1 |
| 1%淀粉溶液(mL) | 1 | 1 | 1 | 1 |
| 唾液淀粉酶液(mL) | 1 | 1 | 1 | 1 |
| 各试管放入37℃恒温水浴保温适宜时间 | ||||
| 取出试管,加入1%碘溶液0.1mL | ||||
| 观察结果 | 无色 | 深蓝色 | 浅蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2至SO42-沉淀完全:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| B. | 碳酸钠溶液与醋酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 氢氧化亚铁与硝酸混合:Fe(OH)2+2H+=Fe2++2H2O | |
| D. | 将1~2mL氯化铁饱和溶液加到20mL沸水中:Fe3++3H2O?Fe(OH)3(胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子 | |
| C. | 奥运会中采用的新型氢动力计程车可以降低PM2.5的排放,减小大气污染 | |
| D. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 C70分子是形如椭球状的多面体,该结构的建立基于以下考虑
C70分子是形如椭球状的多面体,该结构的建立基于以下考虑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
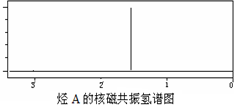
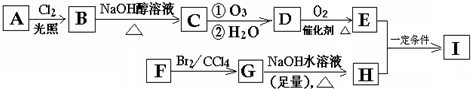
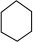 ,C
,C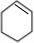 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 样品 | 所加试剂 | 主要操作 | 化学方程式 |
| SiO2(CaCO3) | |||
| CaCO3(SiO2) | |||
| Fe(Si) | |||
| SiO2(H2SiO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com