

 ,其名称为2-甲基-1-丁烯;
,其名称为2-甲基-1-丁烯; +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;分析 A与溴水发生加成反应生成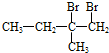 ,则A为
,则A为 .B连续氧化生成
.B连续氧化生成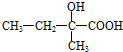 ,则
,则 在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为
在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为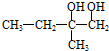 ,C为
,C为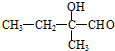 .
. 发生反应⑤生成D,D的分子式为C5H8O2且含有2个甲基,则反应⑤应是在浓硫酸、加热条件下发生消去反应,故D为
发生反应⑤生成D,D的分子式为C5H8O2且含有2个甲基,则反应⑤应是在浓硫酸、加热条件下发生消去反应,故D为 .D与E反应生成惕各酸苯乙酯(C13H16O2),则惕各酸苯乙酯为
.D与E反应生成惕各酸苯乙酯(C13H16O2),则惕各酸苯乙酯为 ,E为
,E为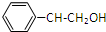 ,
,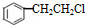 发生水解反应生成苯甲醇,据此分析解答.
发生水解反应生成苯甲醇,据此分析解答.
解答 解:A与溴水发生加成反应生成 ,则A为
,则A为 .B连续氧化生成
.B连续氧化生成 ,则
,则 在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为
在氢氧化钠水溶液、加热条件下发生水解反应生成B,B为 ,C为
,C为 .
. 发生反应⑤生成D,D的分子式为C5H8O2且含有2个甲基,则反应⑤应是在浓硫酸、加热条件下发生消去反应,故D为
发生反应⑤生成D,D的分子式为C5H8O2且含有2个甲基,则反应⑤应是在浓硫酸、加热条件下发生消去反应,故D为 .D与E反应生成惕各酸苯乙酯(C13H16O2),则惕各酸苯乙酯为
.D与E反应生成惕各酸苯乙酯(C13H16O2),则惕各酸苯乙酯为 ,E为
,E为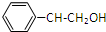 ,
,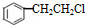 发生水解反应生成苯甲醇,
发生水解反应生成苯甲醇,
(1)反应④的生成物含有的官能团名称为羧基和醇羟基,故答案为:羧基和醇羟基;
(2)A的结构简式为 ,其名称为2-甲基-1-丁烯,故答案为:
,其名称为2-甲基-1-丁烯,故答案为: ;2-甲基-1-丁烯;
;2-甲基-1-丁烯;
(3)反应②是 在氢氧化钠水溶液、加热条件下发生水解反应生成
在氢氧化钠水溶液、加热条件下发生水解反应生成 ,需要另加的试剂是氢氧化钠水溶液;
,需要另加的试剂是氢氧化钠水溶液;
反应⑤是 在浓硫酸、加热条件下发生消去反应生成
在浓硫酸、加热条件下发生消去反应生成 ,
,
故答案为:氢氧化钠水溶液;浓硫酸、加热;
(4)反应⑦为D与E反应生成惕各酸苯乙酯(C13H16O2)
,该反应方程式为 +
+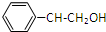 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +
+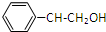 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(5)上述合成路线中,反应①属于加成反应,反应②⑥⑦属于取代反应,反应③④属于氧化反应,反应⑤属于消去反应,故答案为:②⑥⑦;
(6)反应⑥的有机反应物的同类别同分异构体中,氯原子可以连接亚甲基上,氯原子可以连接苯环,且与乙基有邻间对三种结构,所以符合条件的同分异构体有4种,故答案为:4.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,注意合成路线中反应条件、官能团的变化结合正推法或逆推法来推断各有机物是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH≥2.33 | B. | pH≥3.53 | C. | pH≤3.53 | D. | pH≤2.33 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+2H+=Fe2++H2 | |
| B. | 氯化钡溶液中通入足量CO2:Ba2++CO2+H2O=BaCO3↓+2H+ | |
| C. | 碳酸氢钙溶液与盐酸反应:HCO3-+H+=CO2↑+H2O | |
| D. | 澄清石灰水中滴入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 转移电子的数目为0.2NA | B. | 所得溶液中溶质的质量分数为2.3% | ||
| C. | 产生气体的体积为1.12L | D. | 产生的气体含有0.1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用澄清的石灰水可鉴别NaHCO3和Na2CO3 | |
| B. | Na2CO3的热稳定性大于NaHCO3 | |
| C. | 在第③、④、⑤步骤中,溴元素均被氧化 | |
| D. | 工业上通过电解饱和MgCl2溶液制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 75 mL 2 mol•L-1 的NH4Cl | B. | 150 mL 1 mol•L-1 的NaCl | ||
| C. | 50 mL 1.5 mol•L-1 的CaCl2 | D. | 50 mL 3 mol•L-1 的KClO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com