
 .
. .
.分析 (1)碳酸钠和酸反应生成盐、水以及二氧化碳;
(2)原子结构示意图书写:圆内数字为原子的质子数,符号表示电性,圆外的弧线为电子层,弧线上的数字为该层上的电子数,离圆最近的弧线表示第一层,依次向外为第二层、第三层等,据此书写镁原子的原子结构示意图;
(3)铝离子和碳酸氢根发生相互促进水解反应,生成氢氧化铝沉淀和二氧化碳气体;
(4)Fe2O3颜色为棕红色,与铝发生铝热反应生成铁和氧化铝;
(5)空气的主要成分为氧气、氮气,A为短周期某元素,其单质是空气的一种成分,该元素的气态氢化物和其最高价氧化物水化物能反应,为氨气和硝酸的反应,A为氮气,氮氮间存在三键;
(6)A元素为氮元素,化合物乙为氮化铝,氮化铝和水反应生成氢氧化铝和氨气,氨气为含有10个电子的微粒.
解答 解:(1)蒸馒头时,如果发酵的面粉过酸时,使用Na2CO3调节,碳酸钠和酸反应生成盐、水以及二氧化碳,钠盐都极易溶于水,离子反应为:CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+2H+=CO2↑+H2O;
(2)镁原子的质子数为12,有3个电子层,第一电子层容纳2个电子,第二电子层容纳8个电子,最外层容纳2个电子,原子结构示意图为为 ,
,
故答案为: ;
;
(3)氯化铝溶液与碳酸氢钠溶液混合,相互促进水解生成沉淀和气体,则反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)Fe2O3颜色为棕红色,可用作油漆颜料,高温下,铝和氧化铁发生铝热反应生成铁和氧化铝,化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.
(5)空气的主要成分为氧气、氮气,A为短周期某元素,其单质是空气的一种成分,该元素的气态氢化物和其最高价氧化物水化物能反应,为氨气和硝酸的反应,离子化合物甲为NH4NO3,甲中的化学键类型为离子键、共价键,氮气分子中存在氮氮三键,氮原子最外层为8电子,电子式为: ,
,
故答案为:离子化合物;离子键、共价键; ;
;
(6)A元素为氮元素,Al、N组成的氮化铝具有良好电绝缘性,所以乙为AlN,能与水缓慢反应生成含N元素的化合物丙,丙分子中含有10个电子,则丙为NH3,反应为水解反应,同时生成氢氧化铝,该反应的化学方程式为:AlN+3H2O=Al(OH)3↓+NH3↑,
故答案为:AlN+3H2O=Al(OH)3↓+NH3↑.
点评 本题考查了元素化合物知识、物质结构有关知识,掌握钠、镁、铝、铁及其化合物的性质是解答关键,侧重考查学生对知识的迁移应用与分析解决问题能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
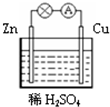
| A. | 负极反应为Cu-2e-═Cu2+ | B. | 正极反应为 Zn-2e-═Zn2+ | ||
| C. | Zn为负极,Cu为正极 | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150ml 0.2mol/L NaCl溶液 | B. | 100ml 3mol/L NH4Cl溶液 | ||
| C. | 300ml 0.1mol/L KCl溶液 | D. | 150ml 0.1mol/L FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上立即用酒精清洗 | B. | 误食铜盐立即喝牛奶或蛋清 | ||
| C. | 动物标本可用福尔马林浸泡防腐 | D. | 伤口处理应先用100%的乙醇消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com