
【题目】现拟用下图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量。
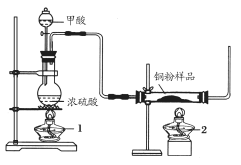
(1)制备一氧化碳的化学方程式是___________________。
(2)实验中,观察到反应管中发生的现象是_____________;尾气的主要成分是_________。
(3)反应完成后,正确的操作顺序为________(填字母)
a.关闭漏斗开关 b.熄灭酒精灯1 c.熄灭酒精灯2
(4)若实验中称取铜粉样品10.0 g,充分反应后,反应管中剩余固体的质量为9.6 g,则原样品中单质铜的质量分数为_____________。
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的最佳方案:
①设计方案的主要步骤是(不必描述操作过程的细节)__________;
②写出有关反应的化学方程式:__________________。
【答案】
(1)HCOOH![]() CO↑+H2O;
CO↑+H2O;
(2)样品粉末逐渐变为红色;CO、CO2;
(3)cab;(4)80%
(5)①将浓硫酸稀释;称取一定量的样品;样品与过量稀硫酸充分反应;过滤、洗涤、干燥、称量、计算;
②CuO+H2SO4===CuSO4+H2O
【解析】
试题分析:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O,反应方程式为HCOOH![]() CO↑+H2O;故答案为:HCOOH
CO↑+H2O;故答案为:HCOOH![]() CO↑+H2O;
CO↑+H2O;
(2)实验中,反应管中发生反应CuO+CO![]() Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;故答案为:样品由黑色变红色;CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;故答案为:样品由黑色变红色;CO、CO2;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作防止空气中O2进入右边装置铜又被氧化为氧化铜了,正确的操作顺序为:熄灭酒精灯2,关闭漏斗开关,最后熄灭酒精1,即cab;故答案为:cab;
(4)若试验中称取铜粉样品10.0g,充分反应后,反应管中剩余固体的质量为9.6g,剩余固体全部为铜,令样品中CuO的质量为m,则:
CuO+CO![]() Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m
80 16
m 10g-9.6g=0.4g
故m=![]() ×0.4g=2g,所以原样品中金属铜的质量分数为
×0.4g=2g,所以原样品中金属铜的质量分数为![]() ×100%=80%;故答案为:80%;
×100%=80%;故答案为:80%;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;故答案为:将浓硫酸稀释;称取一定量的样品;样品与过量稀硫酸充分反应;过滤、洗涤、干燥、称量、计算;
②反应的化学方程式为CuO+H2SO4=CuSO4+H2O;故答案为:CuO+H2SO4=CuSO4+H2O。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】A~J均为有机化合物,它们之间的转化如下图所示:

已知:
1、D既能发生银镜反应,又能与金属钠反应放出氢气:
2、F是环状化合物,核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
3、G是环状化合物,能使溴的四氯化碳溶液褪色;
4、1molJ与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为 由A生成B的反应类型是 反应
(2)C转化为D的方程式为
(3)由E生成F的化学方程式为
H中的非含氧官能团有 (填名称),与E具有相同官能团的E的同分异构体还有
(任写一个,不考虑立体结构);
(4)G的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。

请回答下列问题:
(1)A的结构简式为 ,反应②的化学方程式为 。
(2)反应⑦中物质X的分子式为 ,反应⑧的类型为 。
(3)反应⑤的化学方程式为 。反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是 。
(4)已知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的分子式为 。
(5)请补充完整证明反应①是否发生的实验方案:取反应①的溶液2 mL于试管中 。(实验中可供选择的试剂:10%的NaOH溶液、5%的CuSO4溶液、碘水)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+ Br2= 2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl和Br 的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A.2mol·L-1
B.1mol·L-1
C.0.4mol·L-1
D.0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代有“银针验毒”的记载。“银针验毒”的反应原理之一是4Ag+2H2S+O2=2X+2H2O。下列有关该反应的说法正确的是( )
A.Ag得到电子 B.X为AgS
C.O2被还原 D.每生成1 mo1X转移电子数4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由5种基团-CH3、-OH、-CHO、-C6H5、-COOH两两组成的物质中,在通常情况下能与NaOH溶液反应的物质有 ( )
A.4种 B.5种 C.6种 D.7种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经2s 后测得C的浓度为 0.6molL-1。
2C(g), 若经2s 后测得C的浓度为 0.6molL-1。
(1)现有下列几种说法:
① 物质A表示的反应的平均速率为 0.6mol(Ls)-1;
② 物质B表示的反应的平均速率为 0.15mol(Ls)-1;
③ 2s 时物质A的浓度为1.4molL-1;
④2s 时物质B的转化率为70%。
其中正确的是___________
A. ①③ B. ①④ C. ②③ D. ③④
(2) 若①②中用物质A、B表示的反应速率分别为 0.6mol (Ls)-1、 0.15mol(Ls)-1,则_______(填A或B)物质表示的反应速率更快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为 ,晶体中原子间通过 作用形成面心立方密堆积,其中M原子的配位数为 。
(2)元素Y基态原子的核外电子排布式为 ,其同周期元素中,第一电离能最大的是 (写元素符号)。元素Y的含氧酸中,酸性最强的是 (写化学式),该酸根离子的立体构型为 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为 ,已知晶胞参数a="0.542" nm,此晶体的密度为 g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项中表达正确的是
A.第VⅡA族元素形成的氢化物中沸点最高的是HI
B.第三周期元素形成的简单离子中,半径最小的是Al3+
C.用电子式表示HCl形成过程:![]()
D.水分子很稳定性是因为水分子间易形成氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com