
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)在氧化还原反应中,化合价升高值=化合价降低值=转移电子数来计算;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
A.Cr2O72-和CrO42-的浓度相同,不一定平衡,故A错误;
B.2υ(Cr2O72-)=υ(CrO42-)不能证明正逆速率相等,所以不是平衡状态,故B错误;
C.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故C正确;
故选C;
(3)还原1mol Cr2O72-离子,铬元素化合价从+6价降低到+3价,一共得到电子6mol,亚铁离子被氧化为+3价,应该得到6mol电子,所以还原1mol Cr2O72-离子,
需要6mol的FeSO4•7H2O,
故答案为:6;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\sqrt{\frac{Ksp}{c(C{r}^{3+})}}$=$\sqrt{\frac{1{0}^{-32}}{1{0}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
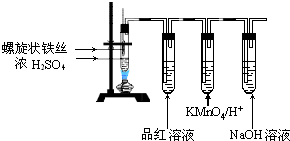
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
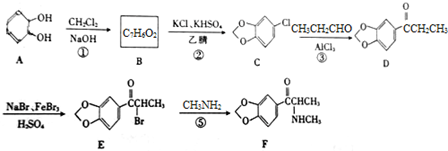
 ;
; (填结构简式);
(填结构简式); )的合成路线.
)的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 开始沉淀的pH值 | 完全沉淀的pH值 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.4 | 4.4 |
| Cr (OH)3 | 4.6 | 5.9 |
| Fe(OH)2 | 7.5 | 9.7 |
| Bi(OH)3 | 0.7 | 4.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
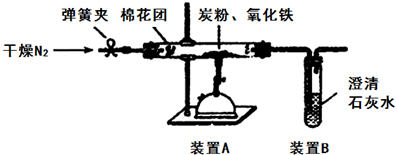
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:
A、B、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大.A元素可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1 817kJ/mol,I3=2 745kJ/mol,I4=11 575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
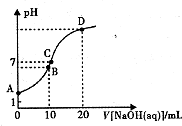 常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )
常温下,用0.1 mol/LNaOH溶液滴定10mL 0.1mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示.下列说法不正确的是( )| A. | A点溶液中加入少量水:$\frac{c(O{H}^{-})}{c({H}_{2}A)}$增大 | |
| B. | B点:c( HA -)>c(H+)>c(A2一)>c(H2A) | |
| C. | C点:c(Na+)=c(HA-)+2c( A2-) | |
| D. | 水电离出来的c(OH-):B点>D点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com