
在盛有50 mL澄清饱和石灰水的小烧杯中放入一小块钠,不可能观察到的现象是
 A.钠熔化成银白色小球 B.在液面快速游动
A.钠熔化成银白色小球 B.在液面快速游动
























 C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
C.溶液底部出现光亮的银白色固体 D.溶液变浑浊
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
合金与纯金属制成的金属材料相比,优点是 ( )
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
A.②③④ B.①②③⑤
C.①②④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
锌烂板液是制作印刷锌板时用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和自来水带进的Cl-、Fe3+等杂质离子。某兴趣小组在实验室中由锌烂板液制取ZnSO4·7H2O的步骤如下:
①在锌烂板液中逐渐加入6 mol/L氢氧化钠溶液,用pH试纸检验,直至pH=8;
②过滤后得到粗Zn(OH)2沉淀,用蒸馏水多次洗涤沉淀;
③用2 mol/L硫酸慢慢将洗净的粗Zn(OH)2沉淀溶解,保持一定pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液;
④在滤液中注入2 mol/L的硫酸,调节pH为2左右,后经相关操作得到ZnSO4·7H2O晶体。
已知:常温下,Fe3+在pH=1.9开始沉淀,pH=3.2沉淀完全;Zn2+在pH=6.4开始沉淀,pH=8.0沉淀完全;Zn(OH)2的化学性质与Al(OH)3相似。
(1)在以上所有步骤中都需要用到的仪器是烧杯、___________。
(2)步骤②的目的是除去________________等杂质离子,检验沉淀是否已洗净的具体操作是________________。
(3)步骤①保持pH=8的目的是________________,步骤④保持pH =2的目的是________________。
(4)步骤③为了除去Fe3+,故保持的pH范围为_____________,加热煮沸的目的是________________。
(5)步骤④中得到ZnSO4·7H2O晶体的操作步骤为____________、________________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.发生化学反应时得到电子越多,非金属原子的氧化能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有1mol的FeCl2溶液中通入0.2molCl2,再加入含0.1mol X2O72- 的酸性溶
液,使溶液中Fe2+全部恰好氧化,并使 X2O72- 还原为Xn+,则n值为
 A.2 B.3 C.4 D.5
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
Ca2+(aq)+2OH-(aq),当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法中正确的是
A.溶液中Ca2+数目减少 B.溶液中c(Ca2+)增大
C.溶液的pH增大 D.溶液中溶质的质量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,Z分别与X,Y形成B、C两种电子数均等于10的分子 且一个B分子中含有的Z原子个数比C分子中少1个 请回答下列问题:
(1)Y元素在周期表中的位置是 周期 族。
(2)B的电子式是 ,B与C反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
①久置于空气中的氢氧化钠溶液,加盐酸时有气体产生
②浓硫酸可用于干燥氨气、二氧化氮气体
③SiO2和CO2都是酸性氧化物,都能与强碱溶液反应,但不能与任何酸反应
④玻璃、水泥、水晶项链都是硅酸盐制品
⑤蔗糖炭化的演示实验中,浓硫酸既体现了其强氧化性又体现了其脱水性
A.①④⑤ B.①⑤ C.②③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应,并在600 T的加热基板上生成氮化硅膜:
3SiH4+4NH3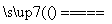 Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
4NH3↑+SiH4↑+2MgCl2 (ΔH<0)
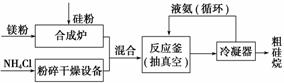
①NH4Cl中的化学键类型有______________________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是______________________________________
________________________________________________________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式________________________________________________________________________,
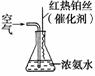 实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
实验室可利用如右图所示装置完成该反应。在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2 )三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余的酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为__________________________________
____________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol·L-1盐酸中,充分反应后,滤去沉淀,用0.1 mol·L-1 NaOH溶液滴定剩余的盐酸,消耗NaOH溶液
30 mL,则Mg2Si3O8·nH2O中的n值为__________。(注:Mg2Si3O8的摩尔质量为
260 g·mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com