
分析 根据向50.00mL0.009mol•L-1Ba(NO3)2溶液中加入50.00mL 0.010mol•L-1稀硫酸发生反应硫酸过量,生成硫酸钡沉淀,再由过量的硫酸根结合Ksp(BaSO4)=1.1×10-10,计算混合后溶液中c(Ba2+),由溶液中的氢离子浓度计算pH.
解答 解:向50.00mL0.009mol•L-1Ba(NO3)2溶液中加入50.00mL 0.010mol•L-1稀硫酸发生反应生成硫酸钡沉淀和硝酸,则过量的硫酸浓度为$\frac{0.01-0.009}{2}$=0.0005mol•L-1,又Ksp(BaSO4)=1.1×10-10,所以混合后溶液中c(Ba2+)=$\frac{1.1×10{\;}^{-10}}{0.0005}$=2.2×10-7mol•L-1,
因为反应前后没有消耗氢离子,所以混合后溶液中c(H+)=$\frac{0.010×2}{2}$mol/L=0.01mol/L,所以pH=2;
故答案为:2.2×10-7;2.
点评 本题考查难溶电解质的溶度积的计算以及pH值的计算,题目难度中等,注意溶液混合体积的变化.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
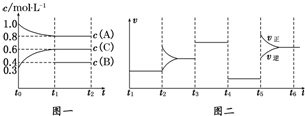
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
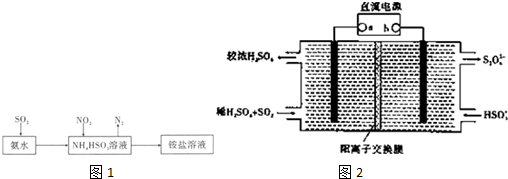
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 | |
| B. | 溶度积常数是不受任何条件影响的常数,简称溶度积 | |
| C. | 可用离子积Qc与溶度积Ksp的比较来判断沉淀溶解平衡进行的方向 | |
| D. | 所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ④⑤⑥⑧ | C. | ③④⑥⑧ | D. | ②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com