
【题目】用NA表示阿伏伽德罗常数,下列说法正确的是( )
A.2g重水(D2O)中含有的中子数是0.1mol
B.0.1molF-中含有的电子数大于6.02×1023
C.1mol1H216O2中的中子数是1mol1H216O中的中子数的2倍
D.ag![]() S原子所含电子数
S原子所含电子数![]() NA
NA
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
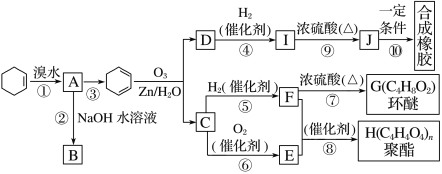
已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反应条件是_________________________________________________。
(2)A的名称是_______________________________________________。
(3)有机物B和I的关系为________(填字母)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑩中属于取代反应的________________________________________。
(5)写出反应⑩的化学方程式____________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。如图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。

(1)上述流程中,为加快化学反应速率而采取的措施是_____。
(2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是_____。
(3)过程Ⅱ中加入过量铁粉的目的是_____,该过程中用到的分离操作是_____。
(4)过程Ⅲ中,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:

下列说法不正确的是_____(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期前10号元素组成的物质T和X,存在如图所示的转化关系。X不确定,易分解。下列有关说法正确的是
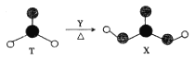
A.为使该转化成功进行,Y可以是酸性KMnO4溶液
B.等物质的量的T、X分子中含有π键的数目均为NA
C.T、X分子中的![]() 原子分别采用sp2杂化和sp3杂化
原子分别采用sp2杂化和sp3杂化
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上用废铁为主要原料生产氧化铁黄的一种工艺流程如下:
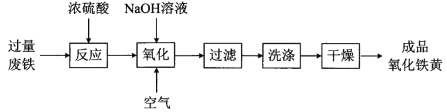
(1)氧化铁黄中铁元素的化合价为_____,废铁在反应前常用热的纯碱溶液清洗表面油污,其原理是______ (写离子方程式)。
(2)氧化过程生成氧化铁黄的化学方程式是_____________。
(3)上述流程中,检验“洗涤”是否完全的方法是________。
(4)氧化时应控制pH的合理范围是3.5-4.0,pH过小导致氧化铁黄产率较低的可能原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于___区,单质X的晶体类型为_____,其中X原子的配位数为_____。
(2)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是__________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。

该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
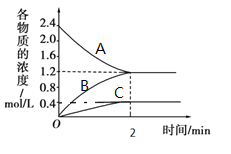
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为交警在对驾驶员是否饮酒进行检测。其原理是:K2Cr2O7酸性溶液遇呼出的乙醇蒸气迅速反应。下列对乙醇的描述与此测定原理有关的是( )

①乙醇沸点低
②乙醇密度比水小
③乙醇具有还原性
④乙醇是烃的含氧衍生物
⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
A.②⑤B.②③C.①③D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com