
| A. | ①③④ | B. | ①③⑥ | C. | ③④⑤ | D. | ②④⑥ |
分析 ①碱金属单质的电荷相同,半径越大,单质的熔点越低;
②元素的非金属性越强,气态氢化物的稳定性越强;
③元素的非金属性越强,对应的最高价含氧酸的酸性越强;
④氨气溶于水,其溶液显碱性;
⑤根据元素周期表中同主族元素性质的变化规律来分析;
⑥根据元素周期表中同周期元素性质的变化规律来比较金属性,金属性越强,则最高价氧化物对应水化物的碱性越强.
解答 解:①碱金属元素的原子的半径随原子序数的增大而增大,则单质的熔点随原子序数的增大而降低,故①正确;
②第VIIA族Cl元素的非金属性大于砹的非金属性,则砹的氢化物的稳定性小于HCl,故②错误;
③S、Se在同一主族,S元素的非金属性大于Se的非金属性,则硒的最高价氧化物对应水化物的酸性比硫酸弱,故③正确;
④第二周期非金属元素N,其氢化物为氨气,氨气溶于水,水溶液为碱性,故④错误;
⑤铊(Tl)与铝同主族,随原子序数的增大,金属性增强,则金属性Tl>Al,则Tl能与酸反应,但不与氢氧化钠溶液反应,故⑤错误;
⑥第三周期金属元素随原子序数的增大金属性减弱,金属性Na>Mg>Al,则金属元素的最高价氧化物对应水化物,其碱性随原子序数的增大而减弱,故⑥正确;
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握同周期和同主族元素的性质变化规律、金属性与非金属性强弱的比较方法是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 充电时电源的正极应与电池的X极相连 | |
| B. | 放电时负极电极反应式为:XH6+6e-═X+6H+ | |
| C. | 充电时阳极电极反应式为:6Ni(OH)2+6OH-═6NiOOH+6H2O+6e- | |
| D. | 该电池放电反应1 mol XH6时,若用于电解水,理论上可得到16g氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在空气中燃烧的火焰呈黄色,是因为生成的Na2O2为淡黄色固体 | |
| B. | 铁丝在Cl2中燃烧有红棕色的烟,是因为生成的FeCl3为红棕色固体 | |
| C. | 过量的铁加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色,说明稀HNO3将Fe氧化为Fe3+ | |
| D. | 取少量溶液X,向其中加入适量新制的氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | HBr的电子式为H+(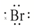 )- )- | |
| C. | 3.4g氨气中含有0.6NA个N-H键 | |
| D. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,D在元素周期表中的位置第3周期,第VIA族.
,D在元素周期表中的位置第3周期,第VIA族.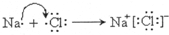 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
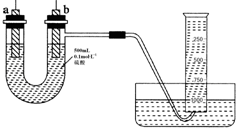 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com