
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
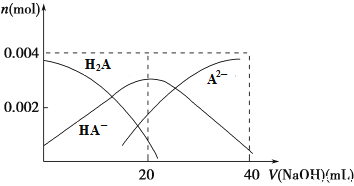
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
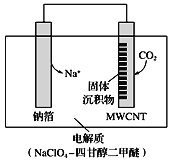
①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
【答案】 ④>②>①>③ c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) 小 Cr2O72-+6Fe2+ +14H+=2Cr3++6Fe3++7H2O 3.0×10-6mol·L-1 3CO2+4Na++4e-===2Na2CO3+C 15.8
【解析】试题分析:(1)①NH4NO3、③(NH4)2SO4中铵根离子水解溶液呈酸性,(NH4)2SO4中铵根离子的浓度大于NH4NO3,所以(NH4)2SO4的酸性强;②CH3COONa、④Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解大于 醋酸根离子,所以碱性Na2CO3大于CH3COONa;(2)向20mL0.2mol/LH2A溶液中滴加20mL 0.2mol/LNaOH溶液,恰好生成NaHA,根据图示此时H2A小于A2-,说明HA-电离大于水解,所以溶液呈酸性;HA-电离出的氢离子抑制水电离;(3)①Cr2O72-与Fe2+发生氧化还原反应,生成Cr3+、Fe3+;②根据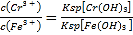 计算Cr3+的浓度;(4)4Na+3CO2
计算Cr3+的浓度;(4)4Na+3CO2![]() Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳;②根据图示,碳酸钠、碳都在正极生成。
Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳;②根据图示,碳酸钠、碳都在正极生成。
解析:(1)①NH4NO3、③(NH4)2SO4铵根离子水解溶液呈酸性,(NH4)2SO4中铵根离子的浓度大于NH4NO3,所以(NH4)2SO4的酸性强;②CH3COONa、④Na2CO3都是强碱弱酸盐,溶液显碱性,碳酸根离子水解大于 醋酸根离子,所以碱性Na2CO3大于CH3COONa,所以pH从大到小排列顺序为④>②>①>③;(2)向20mL0.2mol/LH2A溶液中滴加20mL 0.2mol/LNaOH溶液,恰好生成NaHA,此时H2A小于A2-,说明HA-电离大于水解,所以溶液呈酸性,所以溶液中离子浓度大小关系c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);HA-电离出的氢离子抑制水电离水的电离程度比纯水小;(3)①Cr2O72-与Fe2+发生氧化还原反应,生成Cr3+、Fe3+,反应离子方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;②根据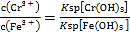 ,c(Cr3+)=
,c(Cr3+)=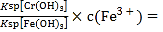 3.0×10-6mol/L;(4)4Na+3CO2
3.0×10-6mol/L;(4)4Na+3CO2![]() Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳,电极反应是3CO2+4Na++4e-=2Na2CO3+C;②根据3CO2+4Na++4e-=2Na2CO3+C,转移0.2mol电子,生成0.1mol Na2CO3和0.05mol C,质量是
Na2CO3+C,碳元素化合价降低,所以是二氧化碳在正极发生还原反应生成碳,电极反应是3CO2+4Na++4e-=2Na2CO3+C;②根据3CO2+4Na++4e-=2Na2CO3+C,转移0.2mol电子,生成0.1mol Na2CO3和0.05mol C,质量是![]() 11.2g,负极消耗钠0.2mol ,消耗钠4.6g,所以两极质量差是15.8g 。
11.2g,负极消耗钠0.2mol ,消耗钠4.6g,所以两极质量差是15.8g 。


科目:高中化学 来源: 题型:
【题目】甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2与Na2SO3溶液反应,实验装置如下。
①写出制取氯气的化学方程式______________。
②该装置的不足之处除无尾气吸收装置外,另一处是______________。
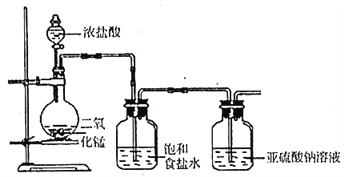
③Cl2与Na2SO3溶液反应的离子方程式为____________。
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化_________。
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
实验试剂 | 试管I | 试管II | 试管Ⅲ | 试管IV |
乙酸乙酯/mL | 1 | V1 | V2 | V3 |
1mol/LNaOH/mL | V4 | 3 | 0 | V5 |
蒸馏水/mL | 0 | V6 | 5 | 2 |
⑤请完成上表,其中V2=______,V4=______,V5=_______。
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是____;实验中,试管IV比试管II中的酯层减少更快,其原因有:温度高速率快,还可能有_________。 (乙酸乙酯沸点为77.1℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是( )
A.蜂蜜中含有的葡萄糖
B.石油中含有的C16H34
C.芹菜中含有的纤维素
D.植物油中含有的油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下实验方案中,可以达到相应实验目的的是
A | B | C | D | |
方 案 |
|
|
|
|
目 的 | 验证不同催化剂对化学反应速率的影响 | 分离乙醇和水 | 将锌板换成铜板 对钢闸门保护效果更好 | 已知:Na2SiO3 + CO2 + H2O == Na2CO3 + H2SiO3↓ 验证非金属性:C > Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在组成人体的各种化学元素中,最基本元素、含量最多的元素、占细胞干重最多的元素依次是
A.C、O、C B.C、H、O C.C、O、N D.C、O、O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五种有机物:①CH4、②CH2=CH2、③CH3CH2OH、④ CH3 CH2CH2 CH3 、⑤CH3COOH
请回答:
(1)写出⑤的官能团的名称______。
(2)与①互为同系物的是______(填序号)。
(3)写出④ 的同分异构体的结构简式________________。
(4)写出与②发生加成反应生成乙烷的化学方程式_________________________。
(5)③与⑤发生反应的化学方程式______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com