
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g) 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是 ( )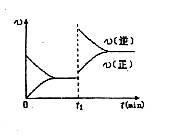
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
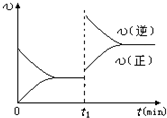
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
C
解析解本题学生应明确化学反应速率的基本公式V=△C÷△t 和化学反应速率的表示规律;外在条件对化学平衡移动方向的影响。
知有反应 A(g)+3B(g) 2C(g)
2C(g)
始 1 2 0 mol
2分钟末 1-0.1 2-0.3 0.2 mol
变化 0.1 0.3 0.2 mol
A应为:V(B)= V(C)=
V(C)=  ×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
B应为:2分钟末A的转化率为 = 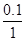
 100% =" 10%"
100% =" 10%"
C:正确。升高温度从图中可见:逆反应速率增大的倍数大于正反应速率增大的倍数,平衡向逆反应方向移动,即逆反应吸热,正反应放热。
D:错误,本反应反应物气体系数和为4,生成物气体系数为2,增大压强平衡向气体体积减小的方向移动。应为,正反应速率增大的倍数大于逆反应速率增大的倍数。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:A(g)+3B(g)?2C(g)经2分钟反应达到平衡,此时生成0.2mol C.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:


 ,判断其中的化学键的类型
,判断其中的化学键的类型查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届湖南省、四中)两校联考高一下学期期末考试化学 题型:实验题
主族元素A、B、C、D、E的原子序数都小于18,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体F。此液体与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。E的最高价氧化物的水化物既能与酸反应生成盐和水又能与碱反应生成盐与水。回答下列问题:
⑴写出元素符号A , C 。
⑵E元素的最高价氧化物和盐酸反应的离子方程式为 : 。
⑶用电子式表示F的形成过程 。
在加热的条件下B、D形成的化合物的电子式为 ,其中的化学键的类型为 。
⑷写出一种有A、B、C、D组成的化合物的化学式 。
(5)B的气态氢化物是天然气的主要成分,它的空间结构为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com