
| A. | 向l0mL0.1mol•L-1FeI,溶液中缓缓通人标准状况下11.2mL Cl2 | |
| B. | 向AlCl3溶液中滴加Na2S溶液 | |
| C. | 向含有Na+、Fe2+、Cl-、SO42-离子的溶液中通入NO2 | |
| D. | 向5mL0.1 mol•L-1NaOH溶液中,逐滴加入1 mL0.1 mol•L-1AlCl3溶液,边滴加边振荡 |
分析 A.根据氯气具有强氧化性,可以氧化FeI;
B.根据铝离子与硫离子发生双水解反应生成氢氧化铝和硫化氢气体判断;
C.根据二氧化氮通入溶液与水反应生成硝酸,硝酸具有强氧化性可以氧化二价铁离子;
D.向5mL0.1 mol•L-1即0.0005molNaOH溶液中,逐滴加入1 mL0.1 mol•L-1即0.0001molAlCl3溶液,只发生Al3++4OH-═AlO2-+2H2O.
解答 解:A.因为氯气具有强氧化性,又碘离子的还原性大于二价铁,所以氯气首先将碘离子氧化成碘单质,会有黑色沉淀产生,故A错误;
B.因为铝离子与硫离子发生双水解反应生成氢氧化铝沉淀和硫化氢气体,所以会有白色沉淀产生,故B错误;
C.因为二氧化氮通入溶液与水反应生成硝酸,硝酸具有强氧化性可以将二价铁离子氧化成三价铁离子,所以溶液会有浅绿色变成浅黄色,故C错误;
D.向5mL0.1 mol•L-1即0.0005molNaOH溶液中,逐滴加入1 mL0.1 mol•L-1即0.0001molAlCl3溶液,只发生Al3++4OH-═AlO2-+2H2O,所以无明显变化,故D正确;
故选D.
点评 本题考查化学反应过程中现象的判断,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握反应的本质,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | Y的气态氢化物最稳定 | B. | Z的单核阴离子还原性最强 | ||
| C. | X单质常温下化学性质活泼 | D. | Y的原子序数比W大7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

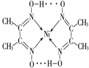 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
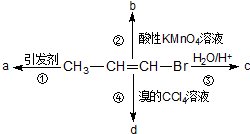 1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )
1-溴丙烯能发生如下图所示的4个不同反应.已知产物a为高分子化合物,则产物中只含有一种官能团的反应是( )| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8mol | B. | <0.9mol | ||
| C. | 0.9mol | D. | 在0.9mol和1.8mol之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com