
分析 (1)反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Cl元素化合价由-1升高到0价,则HCl为还原剂,对应产物Cl2为氧化产物,Mn元素化合价由+4降低到+2价,则MnO2为氧化剂,对应产物MnCl2为还原产物,结合反应的元素的化合价的变化以及方程式计算;
(2)在Cl2+2NaOH=NaCl+NaClO+H2O反应中,氯气中氯元素化合价由0价降低为-1价,氯气是氧化剂,还原产物是氯化钠;氯气中氯元素化合价由0价升高为+1价,氯气是还原剂,氧化产物是次氯酸钠.根据产物可知起氧化剂与还原剂的氯气各占一半,以此解答该题;
(3)在5KI+KIO3+6HCl═6KCl+3I2+3H2O中,KIO3中的碘元素化合价由+5价变成0价,化合价降低被还原,则KIO3为氧化剂,生成I2为还原产物,
KI中的碘元素化合价由-1价变成0价,化合价升高被氧化,则KI为还原剂,生成I2为氧化产物,以此解答该题.
解答 解:(1)反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Cl元素化合价由-1升高到0价,则HCl为还原剂,对应产物Cl2为氧化产物,Mn元素化合价由+4降低到+2价,则MnO2为氧化剂,对应产物MnCl2为还原产物,所以生成1mol Cl2时转移电子数目为2mol,被氧化的HCl的物质的量是2mol,盐酸显示的性质是 还原性和酸性;故答案为:MnO2;Cl2;2mol;2mol;MnO2;Cl2;还原性和酸性;
(2)在Cl2+2NaOH=NaCl+NaClO+H2O反应中,Cl2中氯元素化合价由0价降低为-1价,Cl2是氧化剂,氯元素被还原,还原产物是NaCl;Cl2中氯元素化合价由0价升高为+1价,Cl2是还原剂,氯元素被氧化,氧化产物是NaClO,则1mol Cl2参与反应转移电子数目为1mol,根据产物中氯原子化合价变化,可知起氧化剂与还原剂的氯气各占一半,所以反应的氧化剂与还原剂之比为1:1,故答案为:Cl2;Cl2;NaClO;1mol;1:1;
(3)在5KI+KIO3+6HCl═6KCl+3I2+3H2O中,KIO3中的碘元素化合价由+5价变成0价,化合价降低被还原,则KIO3为氧化剂,生成I2为还原产物,
KI中的碘元素化合价由-1价变成0价,化合价升高被氧化,则KI为还原剂,生成I2为氧化产物,则氧化产物与还原产物的物质的量之比为5:1;根据反应方程式可知,生成3mol碘单质会转移5mol电子,
故答案为:KIO3;KI;I2;5mol;5:1.
点评 本题综合考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高考高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和相关计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH3-CH3 | B. | CH3-CH2-CH3 | C. | CH2=CH-CH3 | D. | CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
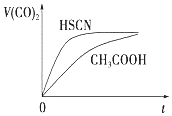 已知 25℃时部分弱电解质的电离平衡常数数据如表:
已知 25℃时部分弱电解质的电离平衡常数数据如表:| 化学式 | HSCN | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-1Ka2=5.6×10-1 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30% | B. | 10% | C. | 20% | D. | 24% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该饱和溶液硫酸铜物质的量浓度为c=$\frac{4a}{v}$ mol•L-1 | |
| B. | 该饱和溶液中硫酸铜的质量分数为w=$\frac{16a}{a+b}$% | |
| C. | 25℃硫酸铜的溶解度为 S=$\frac{1600a}{9a+25b}$g | |
| D. | 该饱和硫酸铜溶液的密度为ρ=$\frac{a+b}{v}$g•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
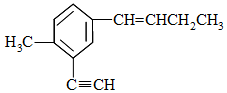
| A. | 与乙苯不互为同系物 | |
| B. | 分子中共直线的碳原子最多有4个 | |
| C. | 分子中共平面的原子最多有20个 | |
| D. | 与其互为同分异构体且萘环上只有一个侧链的共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 比较水和乙醇中氢的活泼性 | 分别讲少量钠投入到盛有水和乙醇的烧杯中 |
| B | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
| C | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
| D | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和的FeCl3溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③ | C. | ①②③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
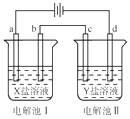 如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | CuSO4 | AgNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | AgNO3 | Pb(NO3)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com