
【题目】下列说法不正确的是( )
A. NA个氧分子与NA个氢分子的质量比等于16∶1
B. 标准状况下,以任意比混合的氢气和一氧化碳混合物22.4 L所含原子数为2NA
C. 标准状况下,0.5NA个H2O分子所占体积约为11.2 L
D. 16 g O2和O3的混合物中共含有NA个氧原子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】聚乙二醇(PEG) 是一种用途广泛的聚合物,1,2-乙二醇碳酸酯(又称为碳酸亚乙酯) 是一种医药中间体。某小组以烃A 为原料合成PEG和碳酸亚乙酯的路线设计如下: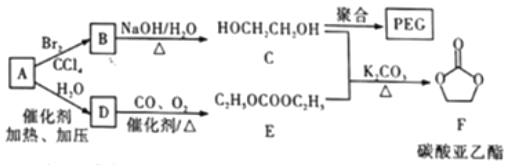
已知: 2C2H5OH+CO+1/2O2 ![]() C2H5OCOOC2H5+H2O
C2H5OCOOC2H5+H2O
回答下列问题:
(1)A→B的反应类型为__________。
(2)B→C的化学方程式为______。
(3)C在一定条件下发生聚合反应生成PEG,若某种PEG的平均相对分子质量为2000, 则其平均聚合度为____________________。
(4)E的同分异构体中,含有—OCOO—基团的共有______ 种(不包含E和立体异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运载火箭常用偏二甲肼(C2H8N2)(其中N的化合价为-3)作燃料和四氧化二氮(N2O4)反应。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4![]() 2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D. 每有0.6 mol N2生成,转移电子数目为2.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
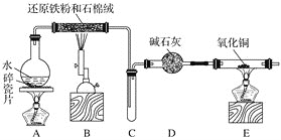
(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性;②使用时加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A.Cl2 B.SO2C.NaClOD.KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,图为实验装置。
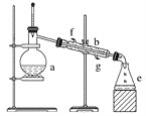
(1)写出下列仪器的名称:
a.____________,b.____________。
(2)蒸馏烧瓶进行加热时盛装液体不要超过烧瓶容量的__________,还需加入几块碎瓷片,其作用是________________________________________________________________________。
(3)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是____________,将仪器补充完整后进行实验,温度计水银球的位置在____________处。冷凝水由________(填f或g)口流入,____________(填f或g)口流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学合成和分离技术是人类生存所必须的,是其他各项技术的基础
B. 氨基酸是指分子中含有﹣COOH和﹣NH2,且连在同一个碳原子上
C. 根据纤维在火焰上燃烧产生的气味,确定该纤维是否为蛋白质纤维
D. Na2SiO3的水溶液俗称水玻璃,用水玻璃浸泡的木材、纺织品耐火耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如下:
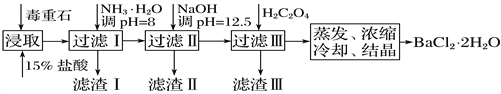
(1)毒重石用盐酸浸取前需充分研磨,目的是_________________________。
(2)已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调pH=8可除去________(填离子符号),滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是______________________________。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O;Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为_______mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com