
【题目】中国科学院科研团队研究发现,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如下。下列说法不正确的是( )
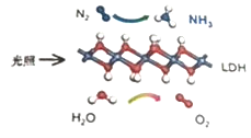
A.该过程将太阳能转化成为化学能
B.该过程中,只涉及到极性键的断裂与生成
C.氧化剂与还原剂的物质的量之比为1:3
D.原料气N2可通过分离液态空气获得
科目:高中化学 来源: 题型:
【题目】如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

(1)通过计算,可知系统(I)和系统(II)制氢的热化学方程式分别为__________________ 、______________________,制得等量H2所需能量较少的是___________。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率a1=_____ %,反应平衡常数K =___________。
②在620K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率a2 _____________a1,该反应的H __________0。(填“>” “<” 或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是 _____ (填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g) + 2O2(g)═ CO2(g) + 2H2O(g) △H = -890.3kJ/mol
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H =-38.6kJ/mol
2NH3(g) △H =-38.6kJ/mol
C.在l01kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g) + O2(g)═2H2O(l) △H =-571.6kJ/mol
D.HCl和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2反应的反应热△H = 2×(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol X和2 mol Y充入2 L密闭容器中发生如下反应:X(g)+3Y(g)2Z(g)+aQ(g)。2min后达到平衡时生成0.8 molZ,测得Q的浓度为0.4 mol/L,下列叙述错误的是( )
A.a的值为2B.平衡时X的浓度为0.8 mol·L-1
C.Y的转化率为60%D.反应速率υ(Y)=0.6 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
(2)25℃、101kPa若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量___。
(3)25℃、101kPa已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨对人类的生产生活具有重要影响。
(1)氨的制备与利用。
① 工业合成氨的化学方程式是________。
② 氨催化氧化生成一氧化氮反应的化学方程式是________。
(1)氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图:

① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用:________。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为________mg·L-1。
(3)氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
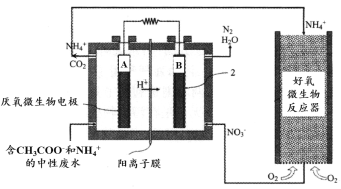
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式:________。
② 用化学用语简述NH4+去除的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如图所示(反应条件已略去)。下列说法错误的是( )
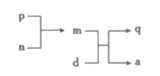
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点B<C
C.d与m反应的现象为d浮在m液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com