

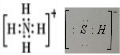 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式;NH3分子间存在氢键,所以NH3的沸点高于H2S;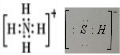 ;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2
;H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,反应过程中生成一水合氨,依据原子守恒和电子守恒配平书写化学方程式为:2NH4HS+O2
| ||
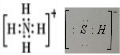 ;2NH4HS+O2
;2NH4HS+O2
| ||
| 1 |
| 4 |
 ,故答案为:
,故答案为: ;
;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、向碳酸钠溶液中滴加少量醋酸:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O |
| B、向次氯酸钠溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- |
| C、向醋酸清洗水垢后氢氧化镁:2CH3COOH+Mg(OH)2═Mg2++2CH3COO-+2H2O |
| D、向漂白粉溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、剩余固体中一定含Cu |
| D、溶液中一定含Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
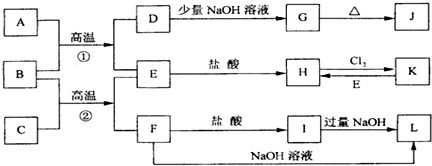
查看答案和解析>>
科目:高中化学 来源: 题型:
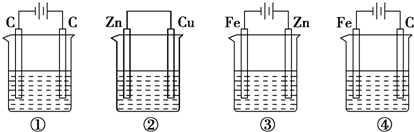
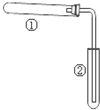 如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )
如图装置(夹持、加热装置已略)进行实验,有②中现象,不能证实①中反应发生的是( )| ①中实验 | ②中现象 | |
| A | 铁粉与水蒸气加热 | 肥皂水冒泡 |
| B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
| C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
| D | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
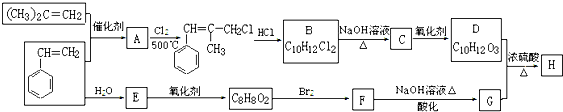
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、还原剂是KNO3和S |
| B、当有12mol电子转移时,有3 mol C被还原 |
| C、1 mol S能氧化0.5 mol C |
| D、当有1mol KNO3参加反应时,有7.224×1024个电子发生转移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com