
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4 •xH2O)中x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:学习小组的同学设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀硫酸.
③用浓度为0.1000mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00mL.
回答下列问题:
(1)配平氧化还原反应方程式:___H2C2O4+___MnO4-+___H+=____CO2↑+Mn2++___H2O
(2)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(3)本实验滴定达到终点的标志是______________________。
(4)通过上述数据,求x的值(写出计算过程)。
(5)误差分析:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
科目:高中化学 来源:2015-2016学年宁夏高二下期末化学试卷(解析版) 题型:选择题
除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
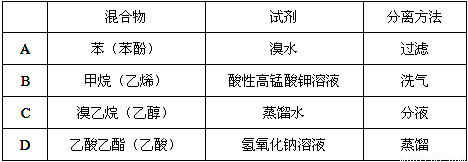
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一下期末化学试卷(解析版) 题型:选择题
对于反应A(g)+3B(g) 2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是
2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是
A.v (A)=0.15 mol/(L?s)
B.v(B)=0.6 mol/(L?s)
C.v(C)=0.4 mol/(L?s)
D.v(D)=0.45 mol/(L?s)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下7.3周考化学试卷(解析版) 题型:选择题
硅是构成无机非金属材料的一种主要元素,下列有关硅的化合物的叙述错误的是( )
A.氮化硅陶瓷是一种新型无机非金属材料,其化学式为Si3N4
B.碳化硅(SiC)的硬度大,熔点高,可用于制作高温结构陶瓷和轴承
C.光导纤维是一种新型无机非金属材料,其主要成分为SiO2
D.二氧化硅为立体网状结构,其晶体中硅原子和硅氧单键的个数之比为1 : 2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下7.3周考化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.混合物的分离是依据混合物中各组分性质的差异进行的,元素分析仪、红外光谱仪、原子吸收光谱仪等均是分离物质的常用仪器
B.道尔顿、汤姆生、卢瑟福、玻尔、阿伏加德罗等科学家在原子结构的认识上作出了重大贡献,他们主要采用的是定量研究和实验研究的方法。
C.煤和石油的综合利用中煤的气化、煤的液化和石油的分馏是物理变化,石油的裂化和裂解、煤的干馏是化学变化
D.某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.77×10-4 | 4.9×10-16 | K1=4.3×10-7 K2=5.6×10-11 |
下列选项错误的是( )
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.HCOOH+CN-=HCOO-+HCN
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一创新班下期末化学试卷(解析版) 题型:选择题
近年来,我国在超导材料研究方面居于世界领先地位,铊(Tl)是超导体的组成成分之一,铊位于第六周期第IIIA族。下列对铊的可能性质的推导正确的是( )
①原子半径比Al大 ②Tl(OH)3是两性氢氧化物
③Tl3+氧化能力比Al3+强 ④单质能与稀硝酸反应生成硝酸盐
A. ①④ B. ②③ C. 只有① D. 只有④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都外国语学校高一下期末理科化学卷(解析版) 题型:选择题
具有如下电子层结构的原子,其相应元素一定属于同一主族的是
A. 2p能级上只有1个空轨道的原子和3p能级上只有1个空轨道的原子
B. 最外层电子排布为3s2的原子和最外层电子排布为4s2的原子
C. 最外层电子排布为ns2的原子和最外层电子排布为ns2np6的原子
D. 2p能级上有2个未成对电子的原子和3p能级上有2个未成对电子的原子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高二下期末化学试卷(解析版) 题型:简答题
【加试题】烟气的主要污染物是SO2、NOx,经臭氧预处理后再用适当溶液吸收,可减少烟气中SO2、NOx的含量。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g) SO3(g)+O2(g) △H=-241.6 kJ·mol-1
SO3(g)+O2(g) △H=-241.6 kJ·mol-1
(1)反应3NO(g)+O3(g)=3NO2(g)的 △H=_ ______ kJ·mol-1。
(2)臭氧脱硝反应2NO2(g)+O3(g) N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
N2O5(g)+O2(g)能自发进行。在温度为T1K时,向体积为2L的恒容密闭容器中充入1 mol O3和2 mol NO2,发生上述反应,经25分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.25 mol·L-1。
①判断该反应的△S__ _____0,△H_ ______0(填>、<或=)。
②在温度为T1K时该反应的平衡常数K= 。
③下列说法正确的是 。
A.从反应开始到达平衡,NO2的平均反应速率v(NO2)=0.04mol·L-1·min-1
B.T1K时,若起始时向容器中充入1 mol O3、2 mol NO2、1 mol O2和1 mol N2O5气体,则反应达到平衡前v(正) <v(逆)
C.若改变反应温度为T2K,测得平衡时NO2的浓度为0.60 mol·L-1,则T2>T1
D.T1K时反应达平衡时容器的体积为2L,若维持T1K压缩容器使NO2转化率为60%,则此时容器的体积约为0.71L
④若维持其他条件不变,仅改变温度为T2K时,经15分钟反应达平衡,测得平衡时N2O5(g)的浓度为0.20 mol·L-1。画出在T2K下从0到25分钟c(NO2)随时间变化图。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com