
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液中:NH4+、Ca2+、Cl-、K+ | |
| B. | Kw/c(OH-)=1.0mol•L-1的溶液中:Mg2+、NO3、NH4+、I- | |
| C. | 中性溶液中:K+、Cl-、Na+、CO32- | |
| D. | 无色溶液中:Fe3+、Cl-、Na+、SCN- |
分析 A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液呈强酸性;
B.Kw/c(OH-)=1.0mol•L-1的溶液呈强酸性;
C.中性溶液中离子之间不反应的能大量共存;
D.无色溶液不含有色离子,且离子之间不反应的能大量共存.
解答 解:A.$\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液呈强酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故A正确;
B.Kw/c(OH-)=1.0mol•L-1的溶液呈强酸性,酸性条件下NO3、I-发生氧化还原反应而不能大量共存,故B错误;
C.如果溶液中存在K+、Cl-、Na+、CO32-,碳酸根离子水解会导致溶液呈碱性而不是中性,故C错误;
D.无色溶液不含有色离子,Fe3+呈黄色不符合无色条件,且Fe3+、SCN-生成络合物而不能大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高频考点,涉及氧化还原反应、络合反应、盐类水解等知识点,明确物质性质及离子反应条件是解本题关键,易错选项是C,C选项采用逆向思维方法分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
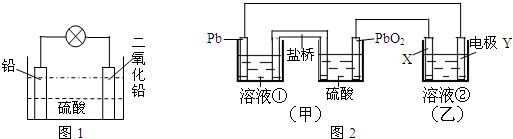
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | Na2CO3溶液中:2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)+c(CO${\;}_{3}^{2-}$) | |
| D. | 常温下,pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3OONa混合液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
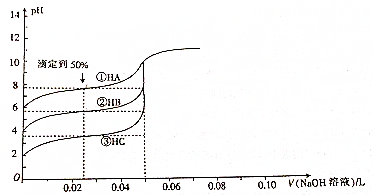
| A. | Ka(HA)>Ka(HB)>Ka(HC) | |
| B. | 滴定到50%时,溶液中:c(A-)>(B-)>(C-) | |
| C. | V(NaOH)溶液=50mL时,溶液中水的电离程度:①>②>③ | |
| D. | V(NaOH)溶液=50mL时,溶液pH的大小关系:pH(A)<pH(B)<pH(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
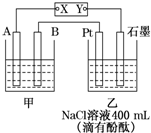 如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极.电解过程中,发现石墨电极附近先变红.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
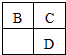
| A. | 简单离子的半径大小关系:B>C>E | |
| B. | D、E两种元素形成的化合物,可能含有离子键和共价键 | |
| C. | B、D分别和C形成的化合物,都有可能使溴水或品红溶液褪色 | |
| D. | A、B、C三种元素形成的化合物,晶体类型一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
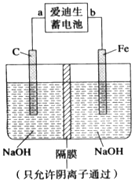 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 425mL | B. | 560mL | C. | 250mL | D. | 500mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com