
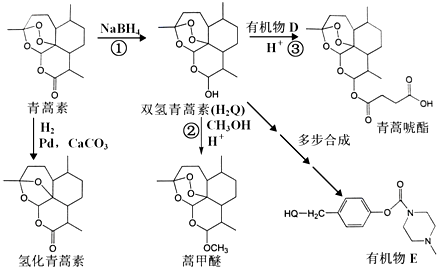
 .
. 外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式
外,还需含苯环的二羟基化合物F,写如有机物F与NaOH溶液反应的离子反应方程式 ,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种.
,有机物G是F的同分异构体,有机物G遇FeCl3溶液显紫色,且有4种不同类型的氢,其个数比为3:2:2:1,则符合条件的有机物G的同分异构体有3种. 分析 (1)由结构简式可确定分子以及含有的官能团;
(2)根据官能团的变化判断,C=O键生成C-OH;
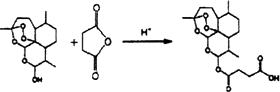
(3)D是分子式为C4H4O3的五元环状化合物,对比氢化青蒿素和青蒿琥酯的结构简式可知应为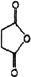 ;
;
(4)青蒿唬酯含有酯基、羧基和过氧键,结合官能团的性质判断;
(5)双氢青蒿素含有羟基,可与甲醇发生分子间脱水生成醚;
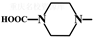
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E,合成过程中,有机原料除H2Q、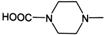 外,还需含苯环的二羟基化合物F,其结构简式为
外,还需含苯环的二羟基化合物F,其结构简式为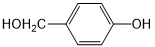 ;化合物G是F的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,S中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位.
;化合物G是F的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,S中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位.
解答 解:(1)由结构简式可知青蒿素的分子式是C15H22O5,含有的官能团为醚键、酯基,故答案为:C15H22O5;醚键、酯基;
(2)反应①中,C=O键生成C-OH,为加成反应(或还原反应),反应中起到还原剂的作用,故答案为:加成反应(或还原反应);B;
(3)D是分子式为C4H4O3的五元环状化合物,对比氢化青蒿素和青蒿琥酯的结构简式可知应为 ,反应的化学方程式为
,反应的化学方程式为 ,
,
故答案为: ;
;
(4)青蒿唬酯含有酯基、羧基和过氧键,具有氧化性,可发生水解反应,具有酸性,可发生酯化反应,可被还原,发生还原反应,
故答案为:ABC;
(5)双氢青蒿素含有羟基,可与甲醇发生分子间脱水,反应的化学方程式为H2Q+CH3OH$\stackrel{H+}{→}$HQ-CH3+H2O,故答案为:H2Q+CH3OH$\stackrel{H+}{→}$HQ-CH3+H2O;
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E,合成过程中,有机原料除H2Q、 外,还需含苯环的二羟基化合物F,其结构简式为
外,还需含苯环的二羟基化合物F,其结构简式为 ,反应第二离子方程式为
,反应第二离子方程式为 ,化合物G是F的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,G中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位,据此确定G的一种结构简式为
,化合物G是F的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,G中含有醚键和酚羟基,且二者位于对位或含有甲基和两个酚羟基,且三个取代基位于间位,据此确定G的一种结构简式为 、
、 ,或
,或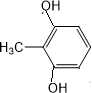 ,共3种,
,共3种,
故答案为: ;3.
;3.
点评 本题考查有机合成,为高频考点,侧重考查学生分析判断能力,明确反应前后有机物结构简式变化方式是解本题关键,注意有机物断键和成键方式,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、煤的液化和煤的干馏均属于化学变化 | |
| B. | 淀粉、纤维素、油脂、蛋白质均属于高分子化合物 | |
| C. | 棉花、羊毛和蚕丝都属于天然高分子 | |
| D. | 陶瓷、水泥和玻璃均属于硅酸盐材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
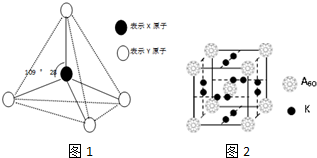
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HBr>HI | |
| B. | 0.1 mol•L-1溶液的pH:NaOH>LiOH | |
| C. | 向Na2SO3溶液中加盐酸,有气泡产生 | |
| D. | Mg、Al与同浓度盐酸反应,Mg更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期放置的漂白粉是因与空气中的氧气发生反应而变质 | |
| B. | 粗硅提纯是利用H2作还原剂,将硅从其氯化物中还原出来 | |
| C. | 利用半透膜除去海水中的NaCl、MgCl2等离子化合物可获得淡水 | |
| D. | 工业上用铝热反应来冶炼Fe、Cr、Mn、V等稀有金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com