
【题目】在FeCl2和AlCl3的混合溶液中加入过量的氨水,直至溶液中沉淀的量不再改变为止。经过滤、洗涤、干燥、在空气中灼烧,最终剩余固体的成分是 ( )
A.Fe2O3、Al2O3 B.Fe2O3
C.Fe (OH)2、Al(OH)3 D.Fe(OH)3、Al(OH)3
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】完成下列填空
(1)决定物质体积的因素有 ①构成物质的粒子数;②粒子大小;③粒子间的距离。对固体、液体物质而言,它主要是由上述______决定(填写编号,下同);对气体物质而言,它主要由上述_____决定。
(2)标准状况下,体积为11.2 L 的CO2的 质量______g,其所含原子的总数是______ 个。
(3)配制100 mL2 molL-1的H2SO4溶液,需要某98%H2SO4溶液(密度为1.8g/cm-3)的体积为________ml(保留三位有效数字)。取配制后的溶液20ml,SO42-的物质的量为______,加入足量的锌,生成标况下氢气的体积为:______ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体,且气体C的水溶液显碱性。

(1)用化学用语按要求填空:
X的化学式为:__________,X中含有化学键类型为__________;A的电子式__________。
(2)写出反应②的离子方程式___________________________。
(3)过量的Fe粉与G的稀溶液反应,向反应后溶液中加入碱溶液,现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年春节,京津冀及周边区域遭遇“跨年”雾霾,二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成,消除氮氧化物污染是研究方向之一。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574.0 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160.0 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
请写出CH4(g)与NO2(g)反应生成N2(g) ,CO2(g)和H2O(l)的热化学方程式_______________________ 。
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)![]() N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g),某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度(mol/L) 时间(min) | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
①下列说法不能作为判断该反应达到化学平衡状态标志的是_______
A.活性炭的质量 B.v 正(N2) = 2v逆 (NO)
C.容器内压强保持不变 D.容器内混合气体的密度保持不变
E.容器内混合气体的平均相对分子质量保持不变
F.容器内CO2的浓度保持不变
②在T0C时,该反应的平衡常数为______________(小数点后保留两位有效数字);
③在30 min时,若只改变某一条件,反应重新达到平衡,则改变的条件是___________;
④在50 min时保持温度和容器体积不变再充入NO和N2,使二者的浓度均增加至原来的两倍,则化学平衡_______(填“正向移动”、“逆向移动”或“不移动”)
(3)利用反应6NO2+8NH3= 7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。

①A电极的电极反应式为______________
②下列关于该电池的说法正确的是(_____)
A.电子从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C.电池工作一断时间,溶液的pH不变
D.当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】月球上有颇为丰富的核聚变燃料He。有关He的说法正确的是( )
A. 原子序数为3 B. 中子数为3
C. 与He互为同位素 D. 核外电子数为3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下:

请根据以上信息和相关知识判断,下列分析不正确的是
A.该“84消毒液”的物质的量浓度为 4.0 mol·L1
B.一瓶该“84消毒液”能吸收空气中44.8 L的CO2(标准状况)而变质
C.取100 mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L1
D.参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含25% NaClO的消毒液,需要称量的NaClO固体质量为143 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂就可以鉴别:①Ba(NO3)2;②AgNO3;③NaCl;④CuCl2,则鉴别出的先后顺序为( )
A. ①③②④ B. ③②④① C. ②③①④ D. ④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。下图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
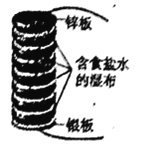
A. 该原电池正极的电极方程式为:O2+4e-+4H+==2H2O
B. 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C. 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g
D. 该伏打电堆工作时,在银板附近会有Cl2放出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com