
| A. | 2molFe2+被氧化时有1molO2被还原 | B. | 该反应中只有Fe2+是还原剂 | ||
| C. | 每生成1molFe3O4转移2mol电子 | D. | 反应方程式中化学计量数x=2 |
分析 根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,则方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,Fe元素的化合价升高,S元素的化合价升高,只有氧气中O元素的化合价降低,以此来解答.
解答 解:A.方程式为3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,反应生成Fe3O4,可知2molFe2+被氧化,有1molO2被还原,故A正确;
B.反应中Fe、S化合价升高,被氧化,还原剂是Fe2+、S2O32-,故B错误;
C.每生成1mol Fe3O4,由电子守恒及O元素的化合价变化可知,转移4mol电子,故C错误;
D.根据氢原子守恒,水的化学计量数为2,则OH-的化学计量数为4,即x=4,故D错误;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度中等.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:解答题
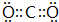 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11:1 | B. | 9:2 | C. | 1:11 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2(g) | △H3 | K3 | |||
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平衡时数据 | CH3OH的浓度(mol/L) | C1 | C2 | C3 |
| 反应体系的能量变化 | aKJ | bKJ | cKJ | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | a1 | a2 | a3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+>Cu2+>Fe2+ | B. | Cu2+>Ag+>Fe2+ | C. | Ag+>Fe2+>Cu2+ | D. | Fe2+>Cu2+>Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2NO2+H2O═2HNO3+NO | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
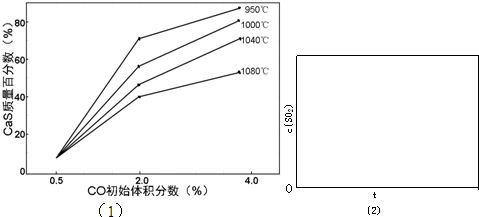
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | n=7,主链上有5个碳原子的烷烃共有五种 | |
| D. | 1mol苯恰好与3mol氢气完全加成,说明一个苯分子中有三个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4与P4的分子结构都是正四面体形,因此在NA个CH4分子或P4分子中都含有4NA个共价键 | |
| B. | 在含NA个硅原子的二氧化硅晶体中含有4NA个Si-O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2NA个电子 | |
| D. | NA个Fe3+完全水解可以得到NA个氢氧化铁胶体粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com