
| A. | 溶液颜色变深可能是Fe2+或I-被氧化 | |
| B. | 原溶液中肯定含有Fe2+、Cl-、NO3-,肯定不含有Na+、Fe3+、I-、CO32- | |
| C. | 取少量原溶液,加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,则原溶液中含有Mg2+ | |
| D. | 该溶液中是否存在Na+,无需通过焰色反应确定 |
分析 往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,只能是亚铁离子被氧化为铁离子,不会是碘离子被氧化为单质碘,所以溶液中一定有Fe2+、Cl-、NO3-,则一定没有I-,亚铁离子与碳酸根离子水解相互促进导致水解完全而不能共存,所以没有碳酸根离子;各离子浓度均0.1mol•L-1,若只有Fe2+、Cl-、NO3-,溶液为电中性,可能还有镁离子和硫酸根离子,溶液仍为电中性,不会有Na+和Fe3+,否则溶液不会是电中性,据此分析.
解答 解:A、溶液中一定没有碘离子,故A错误;
B、往该溶液中加入过量稀盐酸,溶液颜色变深且阴离子种类不变,只能是亚铁离子被氧化为铁离子,不会是碘离子被氧化为单质碘,所以溶液中一定有Fe2+、Cl-、NO3-,则一定没有I-,亚铁离子与碳酸根离子水解相互促进导致水解完全而不能共存,所以没有碳酸根离子;各离子浓度均0.1mol•L-1,若只有Fe2+、Cl-、NO3-,溶液为电中性,可能还有镁离子和硫酸根离子,溶液仍为电中性,不会有Na+和Fe3+,否则溶液不会是电中性,故B正确;
C、加入盐酸酸化的BaCl2溶液,若有白色沉淀产生,说明溶液中含有硫酸根离子,则有镁离子,故C正确;
D、溶液中没有钠离子,故C正确;
故选A.
点评 本题考查了常见阴阳离子的检验、离子共存的判断,题目难度中等,根据离子共存及电中性知识正确判断阴阳离子可能组成为解答关键,试题侧重考查学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题

| A. | 属于芳香烃 | |
| B. | 化学式为:C12H17ON3C12 | |
| C. | 遇FeCl3溶液发生显色反应 | |
| D. | 可在一定条件下发生取代,加成,酯化,消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯锌与稀硫酸反应 | |
| B. | 用粗锌与稀硫酸反应 | |
| C. | 用粗锌与稀硝酸反应 | |
| D. | 在CuSO4溶液中浸泡过的纯锌与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
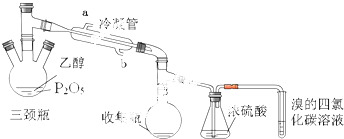
| 实验 | P2O5/g | 92%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
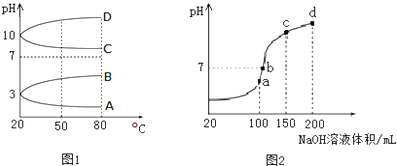
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上制取Cl2:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2OH-+Cl2↑+H2↑ | |
| B. | 碘化钾溶液跟适量溴水反应:2I-+Br2=I2+2Br- | |
| C. | 将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 将氯气通入氯化亚铁溶液中:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
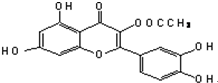
| A. | 5mol、5mol | B. | 5mol、6mol | C. | 6mol、5mol | D. | 6mol、6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2和CH2=CHCH=CH2 | B. | CH3CH2Cl和CH2ClCH2CH2Cl | ||
| C. | C2H5OH和CH4O | D. | CH3COOH和C17H33COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com