
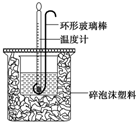
 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和右图所示装置进行测定中和热的实验,得到表中的数据| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃[来源:Z,xx,k.Com] | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.3 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 20.5 | 20.6 | 24.9 |
分析 (1)中和热测定实验成败的关键是保温工作;铜是热的良导体,易传热;
(2)先根据表中测定数据计算出混合液反应前后的温度差,判断有效性,求出平均值,再根据Q=cm△T计算出反应放出的热量,最后计算出中和热;
(3)弱电解质电离吸热.
解答 解:(1)中和热测定实验成败的关键是保温工作,烧杯间填满碎泡沫塑料的作用是:减少实验过程中的热量损失;铜的导热性好,易传热,热量散失较大;故答案为:保温隔热,减少热量损失;不可以;铜的导热性好,易损失热量产生误差
(2)第1次实验盐酸和NaOH溶液起始平均温度为20.3℃,反应后温度为:23.7℃,反应前后温度差为:3.4℃;
第2次实验盐酸和NaOH溶液起始平均温度为20.4℃,反应后温度为:23.8℃,反应前后温度差为:3.4℃;
第3次实验盐酸和NaOH溶液起始平均温度为20.55℃,反应后温度为:24.9℃,反应前后温度差为:4.35℃;
第3次实验误差大,舍去,其他2次的平均值为3.4℃,
50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液的质量和m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为$\frac{1.4212kJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol;
故答案为:56.8;
(3)一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小,测得中和热的数值偏小;
故答案为:偏小.
点评 本题考查热中和热概念、测定原理及反应热的计算,题目难度大,注意理解中和热的概念以及测定反应热的误差等问题.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入过量SO2气体后仍能大量共存H+、Fe2+、I?、SO42? | |
| B. | 使石蕊变红的溶液中可能大量存在Na+、Mg2+、NO3?、C17H35COO? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| D. | 加入Al 可以放出H2的溶液中可能大量存在Fe3+、K+、Cl?、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为Mg-2e-═Mg2+ | |
| B. | 正极反应式为Ag+e-═Ag | |
| C. | 电池放电时Cl-由负极向正极迁移 | |
| D. | 负极会发生副反应Mg+2H2O═Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
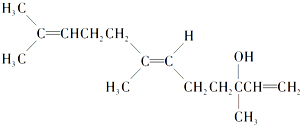
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇在氧气中充分燃烧,需消耗448 L氧气(标准状况) | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗3mol溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子与原子,链节跟链节均以共价键结合 | |
| B. | 原子与原子以共价键结合,链节跟链节以分子间作用力结合 | |
| C. | 原子跟原子、链节跟链节均以非极性共价键结合 | |
| D. | 原子跟原子以非极性共价键结合,链节跟链节以极性共价键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com