
 ,其阴阳离子个数比为1:2.
,其阴阳离子个数比为1:2. 分析 X、Y、Z、T、W五种短周期元素,原子序数依次增大,Y、Z在同周期中处于相邻位置,它们的单质在通常状况下均为无色气体,则Y为N元素、Z为O元素;W原子的最外层电子数是核外电子层数的2倍,原子序数大于氧,只能处于第三周期,最外层电子数为6,故W为S元素;X元素与其它元素不在同一周期,则X为H元素;X与T同主族,T的原子序数大于氧,则T为Na,据此进行解答.
解答 解:X、Y、Z、T、W五种短周期元素,原子序数依次增大,Y、Z在同周期中处于相邻位置,它们的单质在通常状况下均为无色气体,则Y为N元素、Z为O元素;W原子的最外层电子数是核外电子层数的2倍,原子序数大于氧,只能处于第三周期,最外层电子数为6,故W为S元素;X元素与其它元素不在同一周期,则X为H元素;X与T同主族,T的原子序数大于氧,则T为Na,
(1)Z为O元素,原子序数为8,在元素周期表位中位于第二周期VIA,
故答案为:第二周期ⅥA族;
(2)H与O形成的10电子阴离子为:OH-,
故答案为:OH-;
(3)W的一种氧化物具有漂白性,该氧化物为SO2,工业上用Y的气态氢化物氨气的水溶液做其吸收剂,吸收剂与足量氧化物反应的离子方程式:SO2+NH3•H2O═HSO3-+NH4+,
故答案为:SO2+NH3•H2O═HSO3-+NH4+;
(4)化合物Na2O2为离子化合物,含有钠离子和过氧根离子,其电子式为 ,化学式Na2O2中含有1个过氧根阴离子和2个钠离子,则阴阳离子之比为1:2,
,化学式Na2O2中含有1个过氧根阴离子和2个钠离子,则阴阳离子之比为1:2,
故答案为: ;1:2.
;1:2.
点评 本题考查了位置结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握元素周期律内容、元素周期表结构,试题侧重考查学生的分析能力及灵活应用能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
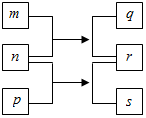 短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.n、p、q是由这些元素组成的二元化合物,m是元素Y的单质,p是一种淡黄色粉末,q的水溶液可在玻璃器皿上蚀刻标记,0.01mol•L-1s溶液的pH为12,上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径:X>Y>Z | |
| B. | 氧化性:r>m | |
| C. | p和q中均含有离子键 | |
| D. | 等体积等浓度的q溶液与s溶液反应后,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓减小的反应通常是自发的,能够自发进行的反应都是焓减小的反应 | |
| B. | 熵增加的反应通常是自发的,能够自发进行的反应都是熵增加的反应 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | △H<0且△S<0的反应一定能自发发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在.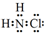 .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
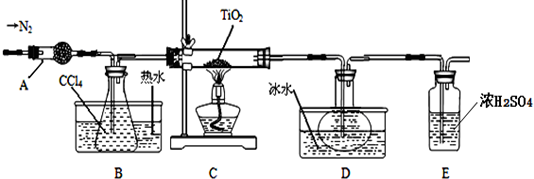
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
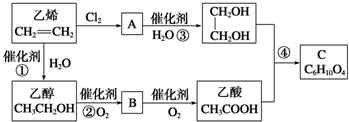
 CH3COOCH2-CH2OOCCH3+2H2O.
CH3COOCH2-CH2OOCCH3+2H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com