
| A. | ①=④>③=② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ④>①=③>② |
分析 ①Na2SO4是强电解质,能在水溶液中完全电离,且由于是强酸强碱盐,不水解,据此分析离子种类;
②H2SO4是强酸,能在水溶液中完全电离,据此分析离子种类;
③NaHSO4是强电解质,能在水溶液中完全电离,且由于是强酸强碱盐,不水解,据此分析离子种类;
④Na2S是强电解质,在溶液中完全电离,但由于S2-是二元弱酸根,故在溶液中水解,且水解分步进行,据此分析离子种类.
解答 解:①Na2SO4是强电解质,能在水溶液中完全电离:Na2SO4=2Na++SO42-,且由于Na2SO4是强酸强碱盐,故不水解,故溶液中的离子有四种:Na+、SO42-、H+、OH-;
②H2SO4是强酸,能在水溶液中完全电离:H2SO4=2H++SO42-,故溶液中的离子种类有三种:H+、SO42-、OH-;
③NaHSO4是强电解质,能在水溶液中完全电离:NaHSO4=Na++SO42-+H+,且由于NaHSO4是强酸强碱盐,故不水解,故溶液中的离子有四种:Na+、SO42-、H+、OH-;
④Na2S是强电解质,在溶液中完全电离:Na2S=2Na++S2-,但由于S2-是二元弱酸根,故在溶液中水解:S2-+H2O?HS-+OH-,HS-+H2O?H2S+OH-,故溶液中的离子种类有五种:Na+、S2-、HS-、OH-、H+.
故选D.
点评 本题考查了溶液中带电微粒种数的判断,题目难度中等,注意把握盐的水解对离子种类的影响,侧重于考查学生对水解知识和电离知识的应用能力.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
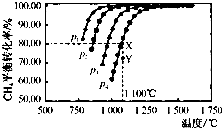
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IO3- | B. | MnO4- | C. | Cl2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、H2、N2 | B. | H2、N2、O2 | C. | CO2、Cl2、HCl | D. | SO2、O2、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
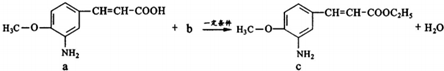
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中CuO和C高温反应的气体产物: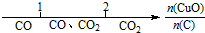 | |
| B. | Na2O2和等物质的量的CO2、H2O(g):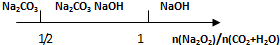 | |
| C. | NaOH溶液中通入一定量的CO2的产物: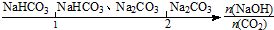 | |
| D. | AlCl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: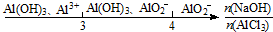 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发酵粉的主要成分为碳酸钠 | |
| B. | 在饱和的碳酸钠溶液中通入二氧化碳,会产生沉淀 | |
| C. | 与盐酸反应的激烈程度:碳酸钠大于碳酸氢钠 | |
| D. | 等质量的碳酸钠和碳酸氢钠与足量的盐酸反应,碳酸钠产生的氢气多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com