
【题目】短周期主族元素X、Y、Z在元素周期表中的相对位置如下图所示。下列说法一定正确的是
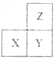
A. 若X为非金属元素,则离子半径:Xn->Ym->Zm-
B. X、Y、Z的单质中,Z单质的熔点最高
C. 最高正化合价:Z>X
D. X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
【答案】A
【解析】试题分析:A.非金属元素的原子获得电子变为同一周期的稀有气体的原子结构。电子层结构相同的离子,核电荷数越大,离子半径越小;电子层结构不同的离子,核外电子层数越多,离子半径越大,所以若X为非金属元素,则离子半径:Xn->Ym->Zm-,正确;B.若X是Si,Y是P,Z是N元素,则单质的熔点最高的是原子晶体的Si,错误;C.若X是S,Y是Cl,Z是 F,则F元素的非金属性是最强的元素,无最高 正化合价,错误;D.同一周期的元素,原子序数越大,元素的金属性越弱;同一主族的元素原子序数越大,元素的金属性越强。所以X、Y、Z的最高价氧化物对应水化物中,X的碱性最强,错误。


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】H1N1病毒是一种没有超常抵抗力的病毒.研究证明,许多常用消毒药物如漂粉精、漂白粉、高锰酸钾等,可以将H1N1病毒杀灭.
(1)工业上制取漂白粉的反应方程式为 。
(2)将漂白粉溶于适量水中,呈白色浊状物,静置沉降.取少许上层清液,滴加碳酸钠溶液出现白色沉淀,写出其中一个化学方程式 。另取少许上层清液,滴加适量的 (填化学式)即可检验Cl﹣的存在,发生反应的化学方程式为 。
(3)漂白粉在空气中长期放置,会失效,用化学方程式解释其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_____________。
(2)操作I需要的玻璃仪器主要有:烧杯、_________,操作Ⅱ的名称是_______________。
(3)操作Ⅲ的主要过程可能是_____________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是______________,装置F中盛放的物质是________________。
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与____________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A.80目、100分钟、50℃ B.60目、120分钟、50℃ C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为: 。
(2)写出反应②④的化学方程式:
② ,反应类型: (1分);
④ ,反应类型: (1分)。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:

①饱和碳酸钠溶液的主要作用是 。
②若要把制得的乙酸乙酯分离出来,应采用的操作是 。
③进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如下表
元素 | 结构或性质信息 |
X | 其原子最外层电子数是内层电子数的2倍 |
Y | 基态原子最外层电子排布为nsnnpn+1 |
Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
M | 单质在常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
Q | 其与X形成的合金为目前用量最多的金属材料 |
(1)Q元素基态原子的电子排布式是________,Y原子的电子排布图是 。
(2)比较Y元素与氧元素的第一电离能____>____;X和Z形成的化合物XZ2为一种液体溶剂,其化学式是 ,分子中的![]() 键和
键和![]() 键数目之比为_____。
键数目之比为_____。
(3)写出实验室制备M单质的离子方程式 。
(4)M的气态氢化物和氟化氢相比(写化学式)
稳定性强的是_____________,其原因是_____________________;
沸点高的是_____________,其原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )

A. 燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B. a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D. a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O![]() H2SO3 +2 OH-
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s)![]() Ag+ (aq) + Cl-(aq)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com