
【题目】下列说法正确的是
A.某有机物分子式为C4H10O,并能与钠反应放出氢气(不含立体异构),其同分异构体数目为5
B.乙烯和苯均能使溴水褪色,且原理相同
C.用水可鉴别乙醇和乙酸乙酯
D.与Na反应的剧烈程度:CH3COOH>CH3CH2OH>H2O
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g) ![]() CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
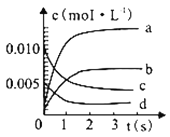
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a 升高温度 b 加入催化剂 c 增大压强 d 及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变
b.v(H2)=2 v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1molCH3OH的同时有2molH-H键断裂
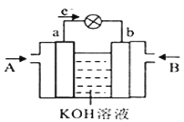
(4)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,图中CH3OH从__________(填A或B)通入,b极的电极反应式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含![]() 等)制备
等)制备![]() 的流程如图所示。
的流程如图所示。

已知:Ⅰ在酸性条件下,![]() 能将
能将![]() 还原为
还原为![]()
Ⅱ. ![]() 的氧化性强于
的氧化性强于![]()
Ⅲ. 相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| 4.9 | 6.8 |
| 1.5 | 2.8 |
回答下列问题:
(1)向含铬废水中加入![]() 调节
调节![]() ,目的是__________。
,目的是__________。
(2)写出“氧化”步骤中反应的例子方程式_________。
(3)“加热”操作的目的是________。
(4)“酸化”过程中发生反应![]()
![]() 已知,“酸化”后溶液中
已知,“酸化”后溶液中![]() 则溶液中
则溶液中![]() =________。
=________。
(5)“结晶”后得到![]() 产品0.3000g,将其溶解后用稀
产品0.3000g,将其溶解后用稀![]() 酸化,再由浓度为
酸化,再由浓度为![]() 标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
标准溶液滴定,滴定终点消耗标准溶液的体积为600mL,则产品的纯度为________。
(6)在![]() 存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
存在下,可利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。
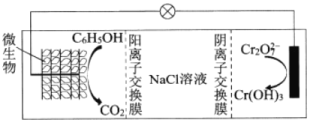
①负极的电极反应式为_________;
②处理过程中,需严格控制正极附近的pH,理由是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质,请在横线上按要求归类。
①H2 ②He ③KOH ④CO2 ⑤H2O2 ⑥CaCl2 ⑦NH4Cl
(1)只由非极性键构成的物质是______________;
(2)由离子键和极性键构成的物质是______________;
(3)属于离子化合物的物质是______________;
(4)⑤H2O2的电子式为:______________;
(5)用电子式表示⑥CaCl2的形成过程:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,2.24 L己烷中共价键数目为1.9NA
B.2 L 0.5 mol/L亚硫酸溶液中含有的H+数为2NA
C.高温下,16.8 g Fe与足量的水蒸气完全反应转移的电子数为0.8NA
D.在密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种新型药物,具有血管扩张活性的选择性β1肾上腺素受体拮抗剂,用于合成该药物的中间体G的部分流程如下:
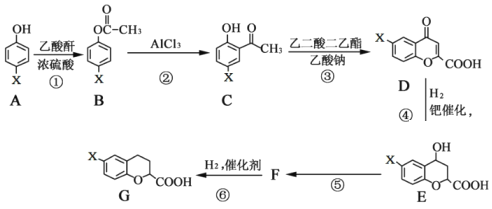
已知:乙酸酐的结构简式为 ![]() 请回答下列问题:
请回答下列问题:
(1)G物质中的含氧官能团的名称是_________________。
(2)乙二酸二乙酯的结构简式为__________________。
(3)反应A→B的化学方程式为__________________。
(4)上述⑤变化过程的反应类型为_________。
(5)有机物F的结构简式为_________。
(6)写出满足下列条件的C的同分异构体有_______种。
Ⅰ. X取代基连接在苯环上; Ⅱ. 能与NaHCO3反应生成CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
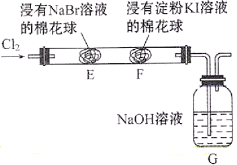
A.E处棉花球变成橙黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-=2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的( )
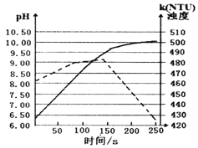
A.该实验是在常温下进行的
B.实线表示溶液浊度随时间的变化
C.50s时向溶液中滴入酚酞试液,溶液变红
D.该反应温度下饱和Mg(OH)2溶液的pH约为10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A元素是1826年一位法国青年科学家发现的,他在研究海水制盐时向剩余的副产物(苦卤)中通入氯气后发现溶液的颜色变深,经过一步提取可得红棕色液体,有刺激性气味;B、C、D的核外电子层数不超过3个,D原子核内的质子数正好等于C原子核内质子数的2倍,而它们的最外层电子数相等;D原子的最内层电子数是B原子核外电子数的2倍。回答下列问题:
(1)四种元素分别为A._____、B.____、C._____、D._____。
(2)A原子的电子排布式为________,D原子的原子结构示意图为______。
(3)写出由上述元素组成的单质和化合物相互作用生成沉淀的两个化学方程式________、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com