
分析 根据物质的性质选择鉴别方法,四组物质中SO2具有漂白性,可使品红褪色,乙烯可与溴发生加成反应,Na和K的焰色反应现象不同,盐酸可与硝酸银反应生成白色沉淀,以此解答该题.
解答 解:①SO2具有漂白性,可使品红褪色,可用品红鉴别;
②C2H4可与溴发生加成反应,可用溴的四氯化碳溶液鉴别;
③HCl溶液和NaNO3溶液加入硝酸银溶液,HCl溶液可生成白色沉淀;
④NaCl溶液和KCl溶液,Na和K的焰色反应现象不同,可用焰色反应鉴别.
故答案为:①;②;③;④.
点评 本题考查物质的鉴别,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
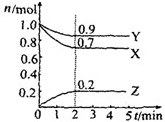 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2a}{3V}$mol/L | B. | $\frac{a}{3V}$mol/L | C. | $\frac{a}{6V}$mol/L | D. | $\frac{a}{4V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,铜是负极 | B. | H+在溶液里流向锌片 | ||
| C. | 负极发生还原反应 | D. | 电子经外电路由锌流向铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
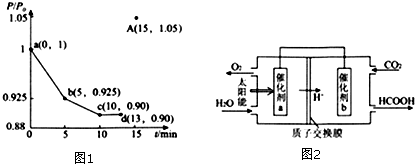
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
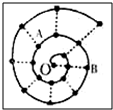 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com