
| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 3.0×10-8 | Ka1=4.3×10-7Ka2=5.6×10-11 |
| A. | 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)═2c(CO32-)+c(HCO3-)+c(CH3COO-) | |
| B. | 常温下,已知酸H2A存在如下平衡:H2A═H++HA-;HA-═H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度 | |
| C. | 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5 |
分析 A.根据溶液中的电荷守恒分析;
B.由Ka2可知,NaHA溶液显酸性,会抑制水的电离;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-;
D.根据Ka=$\frac{c(H{\;}^{+})×c(C{H}_{3}COO{\;}^{-})}{c(CH{\;}_{3}COOH)}$计算c(H+)和pH.
解答 解:A.等物质的量的Na2CO3和CH3COOH两种溶液混合,溶液中的电荷守恒为c(Na+)+c(H+)=2c(CO32-)+c (HCO3-)+c (CH3COO-)+c(OH-),故A错误;
B.已知酸H2A的电离平衡常数Ka2=6.4xl0-6,则NaHA在溶液中以电离为主,则溶液显酸性,会抑制水的电离,所以NaHA溶液中水的电离程度一定小于纯水中水的电离程度,故B错误;
C.相同浓度的CHgCOONa和NaClO混合溶液中,ClO-的水解程度大于CH3COO-,则c (CH3COO-)>c (ClO-),所以溶液中离子浓度关系为c (Na+)>c (CH3COO-)>c (ClO-)>c (OH-)>c (H+),故C错误;
D.已知CH3COOH的电离常数为Ka=1.8×10-5,常温下,在O.lmol/LCH3COOH溶液中滴加O.lmol/LNaOH的溶液发生反应,当c(CH3COOH):c (CH3COO-)=5:9时,Ka=$\frac{c(H{\;}^{+})×c(C{H}_{3}COO{\;}^{-})}{c(CH{\;}_{3}COOH)}$=1.8×10-5,则c(H+)=10-5mol/L,pH=5,故D正确.
故选D.
点评 本题考查了弱电解质的电离、电离平衡常数的计算、溶液中离子浓度相比较等,侧重于基础知识的综合应用的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
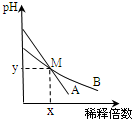
| A. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| B. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 | |
| C. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| D. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后溶液中Fe3+物质的量为0.8 mol | |
| B. | 反应后产生13.44 L H2(标准状况) | |
| C. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 | |
| D. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
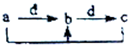 下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )
下表各组物质中,物质之间不能通过一步反应实现如图所示转化的( )| 物质 选项 | a | b | c | d |
| A | Al | Al(OH)3 | NaAlO2 | NaOH |
| B | C | CO | CO2 | O2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | AlCl3 | Al(OH)3 | NaAlO2 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中pH醋酸比盐酸大 | |
| B. | 与足量的锌粉反应产生的氢气体积相同 | |
| C. | 与足量锌粒反应时,一开始盐酸的速率快 | |
| D. | 能中和NaOH溶液的物质的量醋酸较少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com