
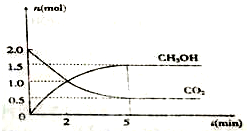
 ����̼ѭ����������ȫ����ĸ߶����ӣ�����CO2��һ�ַ����ǣ�
����̼ѭ����������ȫ����ĸ߶����ӣ�����CO2��һ�ַ����ǣ����� ��1����CO2��g��+3H2��g��?CH3OH��g��+H2O��g���������ʵ������٣����ԡ�S��0������v=$\frac{��c}{��t}$����v��H2����
�ڸ�������ʽ��ƽ�ⳣ������ͼ��֪��CO2����ʼŨ��Ϊ1mol/L��ƽ��ʱŨ��Ϊ0.25mol/L�����c��CO2��=1mol/L-0.25mol/L=0.75mol/L��������Ũ�ȱ仯��Ϊ0.75mol/L��=2.25mol/L��ת����=$\frac{Ũ�ȱ仯��}{��ʼŨ��}$��100%��
�۽�����ƽ����ϵ���¶�������700�棬ƽ�ⳣ��K=5.01���¶�����Kֵ���٣���������Ӧ�Ƿ��ȷ�Ӧ��
a�������¶ȣ���ѧ��Ӧ���ʣ�ƽ�������ƶ���ʹ��ϵ����������ʵ������ӣ�
b����С�������ݻ�����Ӧ��Ũ�ȱ��Ӧ���ʼӿ죬ƽ�������ƶ�����������ʵ������٣�
c��ʹ�ú��ʵĴ�������ѧ��Ӧ���ʼӿ죬ƽ�ⲻ�ƶ������ʵ������䣻
d���ٳ���CO2���壬��ѧ��Ӧ���ʣ�ƽ�������ƶ������ʵ������ӣ�
��2�������Ȼ�ѧ����ʽ���ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ��
��� �⣺��1����CO2��g��+3H2��g��?CH3OH��g��+H2O��g���������ʵ������٣����ԡ�S��0����ͼ��֪��10min����ƽ�⣬ƽ��ʱ�״���Ũ�ȱ仯Ϊ0.75mol/L���ɷ���ʽCO2��g��+3H2��g��?CH3OH��g��+H2O��֪��������Ũ�ȱ仯���ڼ״���Ũ�ȱ仯��Ϊ0.75mol/L��3=2.25mol/L����v��H2��=$\frac{2.25mol/L}{5��60s}$=0.0075mol/��L•s����
�ʴ�Ϊ������0.0075��
��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����
��ʼ��mol/L����1 3 0 0
�仯��mol/L����0.75 2.25 0.75 0.75
ƽ�⣨mol/L����0.25 0.75 0.75 0.75
��ƽ�ⳣ��K=$\frac{0.75��0.75}{0.25��0.7{5}^{3}}$=5.33����ͼ��֪��CO2����ʼŨ��Ϊ1mol/L��ƽ��ʱŨ��Ϊ0.25mol/L�����c��CO2��=1mol/L-0.25mol/L=0.75mol/L��������Ũ�ȱ仯��Ϊ0.75mol/L��=2.25mol/L������ת����=$\frac{\frac{2.25mol/L}{6mol}}{2L}$��100%=75%��
�ʴ�Ϊ��5.33��75%��
�۽�����ƽ����ϵ���¶�������700�棬ƽ�ⳣ��K=5.01���¶�����Kֵ���٣���������Ӧ�Ƿ��ȷ�Ӧ�����ԡ�H��0��
a�������¶ȣ���ѧ��Ӧ���ʣ�ƽ�������ƶ���ʹ��ϵ����������ʵ������ӣ��ʴ���
b����С�������ݻ�����Ӧ��Ũ�ȱ��Ӧ���ʼӿ죬ƽ�������ƶ�����������ʵ������٣�����ȷ��
c��ʹ�ú��ʵĴ�������ѧ��Ӧ���ʼӿ죬ƽ�ⲻ�ƶ������ʵ������䣬�ʴ���
d���ٳ���CO2���壬��ѧ��Ӧ���ʣ�ƽ�������ƶ������ʵ������ӣ��ʴ���
��ѡ��b��
��2����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H=-1275.5kJ•mol-1
��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ•mol-1
��H2O��g���TH2O��l����H=-44.0kJ•mol-1
���ݸ�˹���ɣ�����֪��Ӧ$\frac{1}{2}$������-��+�ۡ�4���õ�CH3OH��l��+O2��g��=CO��g��+2H2O��l�������Ը÷�Ӧ�ġ�H=$\frac{1}{2}$��[��-1275.5kJ/mol��-��-566.0kJ/mol��+��-44.0kJ/mol����4]=-433.75kJ•mol-1����CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-433.75kJ•mol-1��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-433.75kJ•mol-1��
���� ���⿼�����ʵ���Ũ����ʱ��仯���ߣ��漰��ѧ��Ӧ���ʼ���ѧƽ�⡢ƽ�ⳣ���ļ��㣬�ѶȲ���ע��Ի���֪ʶ��ȫ�����գ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����˴������������Һ�뽺�� | |
| B�� | ��ʯ����ˮ��ϵĹ���ֻ���������仯 | |
| C�� | ������ˮֻ�����������仯 | |
| D�� | CuSO4•5H20 ��һ�ֻ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢ� | C�� | �ڢ� | D�� | �٢ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3+3H2O�TAl��OH��3+3HCl | |
| B�� | Na2CO3+2H2O?H2CO3+2NaOH | |
| C�� | ̼��������Һ��HCO3-+H2O?H2CO3+OH-- | |
| D�� | NH4Cl����D2O�У�NH4++D2O?NH3•D2O+H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��1mol�Ȼ�����ȫת��Ϊ�����������壬���ɢϵ�н�������ΪNA | |
| B�� | 22.4LHCl�еķ�����ΪNA | |
| C�� | Na2O2��ˮ�����������0.1molO2ʱת�Ƶĵ�����Ϊ0.2NA | |
| D�� | 0.1mol�����������ᷴӦת�Ƶĵ�����Ϊ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 10g H2��10g N2 | B�� | 1mol H2O��1g H2O | ||
| C�� | 3.2g O2��2.24L�Ŀ��� | D�� | 22gCO2��3.01��1023��O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com