
【题目】按要求回答下列问题
(1)常温下,H2SO3的电离常数Ka1=1.0×10-2、Ka2=1.0×10-7。NaHSO3的水解平衡常数Kh=________,其溶液pH________(填“>”“<”或“=”)7;若向NaHSO3溶液中加入少量的I2(I2能氧化+4价的硫),则溶液中c(H2SO3)/c(HSO3-)将________(填“增大”“减小”或“不变”)。
(2)已知25 ℃时,Ksp[Mg(OH)2]=1.8×10-11。25 ℃时,向0.01 mol·L-1的MgCl2溶液中逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的c(H+)为________;当Mg2+完全沉淀时,溶液的pH为________。(忽略溶液体积变化,已知![]()
![]() ,lg 7.7=0.9)
,lg 7.7=0.9)
(3)量取10.00 mL密度为1.13 g·mL-1的H2O2溶液至烧杯中稀释,冷却后转移至250 mL容量瓶中,加水定容,摇匀。移取配制好的过氧化氢溶液25.00 mL至锥形瓶中,加入稀H2SO4酸化,用蒸馏水稀释,作被测试样。用KMnO4标准溶液滴定被测试样,重复滴定三次,平均耗用1 mol·L-1KMnO4标准溶液11.30 mL,则
①滴定到达终点的现象___________________________________________
②原H2O2溶液中H2O2的质量分数为________。
【答案】1.0×10-12 < 增大 2.4×10-10 11.1 当滴入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30秒内不褪色 85%
【解析】
(1)NaHSO3的水解常数为Kh=![]() =
=![]() ,比较水解常数和二级电离常数(Ka2)大小,判断NaHSO3溶液pH;HSO3-与I-发生氧化还原反应使溶液中c(H+)增大,由一级电离常数Ka1= c(H+) c(HSO3-)/ c(H2SO3)判断;
,比较水解常数和二级电离常数(Ka2)大小,判断NaHSO3溶液pH;HSO3-与I-发生氧化还原反应使溶液中c(H+)增大,由一级电离常数Ka1= c(H+) c(HSO3-)/ c(H2SO3)判断;
(2)Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-),用c(Mg2+)=0.01 mol·L-1计算刚好出现沉淀时,溶液的c(H+);用c(Mg2+)=1×10-5mol·L-1计算完全沉淀时溶液的pH;
(3)①滴定到达终点的现象为当滴入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30秒内不褪色;
②KMnO4溶液与双氧水反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,根据关系式2MnO4-~5H2O2计算的H2O2物质的量,再计算过氧化氢溶液中过氧化氢的质量分数。
(1)NaHSO3的水解常数为Kh=![]() =
=![]() =
=![]() = 1.0×10-12,由于水解常数小于二级电离常数(Ka2),所以NaHSO3在溶液中以电离为主,即溶液显酸性,pH<7;向NaHSO3溶液中加入少量的I2,HSO3-的还原性比I-强,发生氧化还原反应H2O+I2+HSO3-=2I-+SO42-+3H+,溶液中c(H+)增大,由Ka1=1×10-2 = c(H+) c(HSO3-)/ c(H2SO3)可知,溶液中c(H2SO3)/c(HSO3-)将增大,故答案为:1.0×10-12;<;增大;
= 1.0×10-12,由于水解常数小于二级电离常数(Ka2),所以NaHSO3在溶液中以电离为主,即溶液显酸性,pH<7;向NaHSO3溶液中加入少量的I2,HSO3-的还原性比I-强,发生氧化还原反应H2O+I2+HSO3-=2I-+SO42-+3H+,溶液中c(H+)增大,由Ka1=1×10-2 = c(H+) c(HSO3-)/ c(H2SO3)可知,溶液中c(H2SO3)/c(HSO3-)将增大,故答案为:1.0×10-12;<;增大;
(2)Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=0.01·c2(OH-),则c(OH-)=4.2×10-5mol·L-1,c(H+)=Kw/c(OH-)=2.4×10-10mol·L-1,则pH=9.6,即当pH=9.6时,开始出现Mg(OH)2沉淀。一般认为残留在溶液中的离子浓度小于1×10-5mol·L-1时,沉淀已经完全,故Mg2+完全沉淀时有:1×10-5·c2(OH-)=1.8×10-11,则c(OH-)=1.3×10-3mol·L-1,此时,c(H+)=7.7×10-12 mol·L-1,pH=11.1,故答案为:2.4×10-10;11.1;
(3)①用KMnO4标准溶液滴定被测试样,滴定到达终点的现象为当滴入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30秒内不褪色,故答案为:当滴入最后一滴KMnO4标准溶液后,溶液呈浅红色,且30秒内不褪色;
②KMnO4溶液与双氧水反应的离子方程式为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,根据化学方程式可以得到关系式:2MnO4-~5H2O2,耗用1 mol·L-1KMnO4标准溶液11.30mL,即1×11.30×10-3mol的高锰酸钾时,所用双氧水的物质的量:2.5×11.30×10-3mol,则原过氧化氢的质量为:25×11.30×10-3mol×34g/mol,过氧化氢溶液中过氧化氢的质量分数为:(25×11.30×10-3mol×34g/mol)÷(10.00 mL×1.13 g·mL-1)=0.85,即85%,故答案为:85%。


科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是
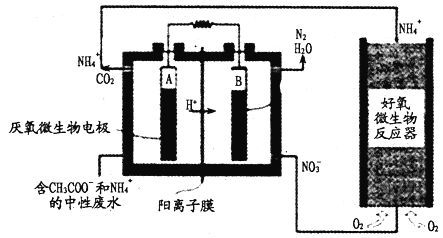
A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2017年中科院某研究团队通过设计一种新型Na-Fe3O4/HZSM-5多功能符合催化剂,成功实现了CO2直接加氢制取辛烷值汽油,该研究成果被评价为“CO2催化转化领域的突破性进展”。
已知:H2(g)+1/2O2(g)=H2O(l) ΔH1=-285.8kJ/mol
C8H18 (1)+25/2O2(g)=8CO2(g)+9H2O(1) ΔH3=-5518kJ/mol
试写出25℃、101kPa条件下,CO2与H2反应生成汽油(以C8H18表示)的热化学方程式________
(2)利用CO2及H2为原料,在合适的催化剂(如Cu/ZnO催化剂)作用下,也可合成CH3OH,涉及的反应有:
甲:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
CH3OH(g)+H2O(g) △H=-53.7 kJ·mol-1平衡常数 K1
乙:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
CO(g)+H2O(g) △H=+41.2 kJ·mol-1平衡常数K2
①CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
CH3OH(g)的平衡常数K=______(用含K1、K2的表达式表示),该反应H_____0(填“大于”或“小于”)。
②提高CO2转化为CH3OH平衡转化率的措施有___________(填写两项)。
③催化剂和反应体系的关系就像锁和钥匙的关系一样,具有高度的选择性。下列四组实验,控制CO2和H2初始投料比均为1:2.2,经过相同反应时间(t1min)
温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) | 综合选项 |
543 | Cu/ZnO纳米棒材料 | 12.3 | 42.3 | A |
543 | Cu/ZnO纳米片材料 | 11.9 | 72.7 | B |
553 | Cu/ZnO纳米棒材料 | 15.3 | 39.1 | C |
553 | Cu/ZnO纳米片材料 | 12.0 | 71.6 | D |
由表格中的数据可知,相同温度下不同的催化剂对CO2的转化为CH3OH的选择性有显著影响,根据上表所给数据结合反应原理,所得最优选项为___________(填字母符号)。
(3)以CO、H2为原料合成甲醇的反应为:CO(g)+2H2(g)=CH3OH(g)。在体积均为2L的三个恒容密闭Ⅰ、Ⅱ、Ⅲ中,分别都充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3且恒定不变。图1为三个容器中的反应均进行到5min时H2的体积分数示意图,其中有一个容器反应一定达到平衡状态。CO的平衡转化率在不同压强下随温度的变化如图所示。
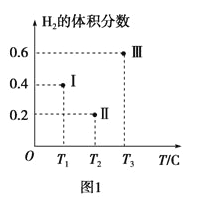

①0~5 min时间内容器Ⅱ中用CH3OH表示的化学反应速率为__________。
②三个容器中一定达到平衡状态的是容器________(填写容器代号)。
③工业实际合成CH3OH生产中,采用图2中M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数
B.升高温度将缩短达到平衡的时间
C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大
D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH===5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。下列说法中正确的是( )

A. 电解过程中OH-从a极区通过离子交换膜c进入b极区
B. 随着电解进行,KOH溶液浓度会逐渐减小
C. a电极反应式:I--6e-+6OH-=== IO![]() +3H2O,a极区的KI最终转变为KIO3
+3H2O,a极区的KI最终转变为KIO3
D. 当阳极有0.1 mol I-放电时,阴极生成6.72 L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为___________________________________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol;用平衡移动原理解释阴极区pH增大的原因:___________________________________________________________
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g)的能量变化如图所示,有关叙述中不正确的是( )
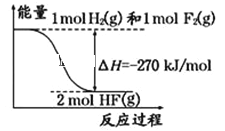
A. 氟化氢气体分解生成氢气和氟气的反应是吸热反应
B. 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C. 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D. 断裂1 mol H﹣H键和1 mol F﹣F 键吸收的能量小于形成2 mol H﹣F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是___________ (填序号)
①正反应速率一定大于逆反应速率
②反应物转化率一定增大
③生成物的产量一定增加
④反应物浓度一定降低
(2)下列溶液:①pH=1的盐酸,②0.05 molL-1的盐酸溶液 ③0.1molL-1的氯化钠溶液 由水电离的H+浓度由大到小顺序是___________(填序号)
(3)在25℃时,某稀溶液中由水电离产生的c(OH-)=10-10molL-1. 该溶液的pH可能为_________________
(4)有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是______________________
(5)一定温度下,可逆反应2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是_______(填序号)
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z和Q在周期表中的位置如图所示,其中元素Q位于第四周期,X、Y、Z原子的最外层电子数之和为17。下列说法正确的是
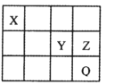
A. 简单离子半径(r):r(Q)>r(Y)>r(Z)
B. 氧化物对应的水化物的酸性:Z>Y
C. XY2和XZ4均含有非极性共价键
D. 标准状况下Z的单质状态与Q的相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com