
| A. | 常温下$\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液中:Ca2+、Fe2+、NO3-、NH4+ | |
| B. | 水电离出的c (H+)=10-10 mol•L-1的溶液中Na+、K+、Cl?、HCO3? | |
| C. | pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- | |
| D. | c(Fe3+)=0.1mol•L-1的溶液中:K+、Cl-、SO42-、H2O2 |
分析 A.常温下$\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液,显酸性;
B.水电离出的c (H+)=10-10 mol•L-1的溶液,为酸或碱溶液;
C.pH=11的溶液,显碱性;
D.Fe3+可加快H2O2的分解.
解答 解:A.常温下$\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol•L-1的溶液,显酸性,H、Fe2+、NO3-发生氧化还原反应,不能共存,故A错误;
B.水电离出的c (H+)=10-10 mol•L-1的溶液,为酸或碱溶液,酸碱溶液中均不能大量存在HCO3?,故B错误;
C.pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.Fe3+可加快H2O2的分解,不能共存,故D错误;
故选C.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 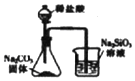 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 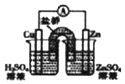 如装置能组成Cu-Zn原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH:①>③>② | |
| B. | 水电离出的(H+):③>②>① | |
| C. | ①和②等体积混合后的溶液:c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | ①和③等体积混合后的溶液呈碱性:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O=Ca(OH)2 | B. | 2Na2O2+2H2O=4NaOH+O2↑ | ||
| C. | 2Na+2H2O=2NaOH+H2↑ | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2D?3B+4C | |
| B. | 反应进行到1s时,v(A)=v(B) | |
| C. | 反应进行到5s时,v(A)=v(B)=v(C)=v(D) | |
| D. | 反应进行到5s时,B的平均反应速率为0.06mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
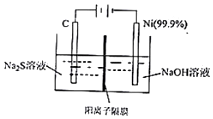 现代煤化工产生的H2S是一种重要的工业资源.请回答:
现代煤化工产生的H2S是一种重要的工业资源.请回答:| 分子 | COS | H2 | H2O | CO | H2S | CO2 |
| 能量/KJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com