
| A. | Q1=Q | B. | Q1>Q | C. | Q1<Q | D. | 无法判断 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
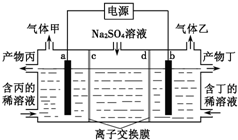
| A. | a极与电源的负极相连 | |
| B. | 产物丙为硫酸溶液 | |
| C. | 离子交换膜d为阴离子交换膜 | |
| D. | 每转移0.1mol e-则产生1.12L气体乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C作还原剂,在反应中被氧化 | |
| B. | 每转移2mol e-时,可产生1mol CO | |
| C. | N2作氧化剂,AlN是还原产物 | |
| D. | 欲制得2molAlN,实际消耗N2体积大于22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
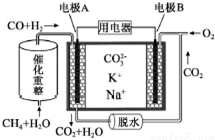
| A. | 电极A上H2参与的电极反应为:CO+H2+2CO32--4e-=3CO2+H2O | |
| B. | 理论上,A极每消耗1molH2,则消耗$\frac{1}{3}$molCH4 | |
| C. | 电池工作时,CO32-向电极A移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
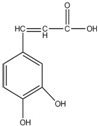
| A. | 该有机物属于烃类 | |
| B. | 与溴水既能发生取代反应,又能发生加成反应 | |
| C. | 1mol咖啡酸最多可与5mol氢气发生加成反应 | |
| D. | 能与Na2CO3溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的金属活动性排在铜前面,所以金属钠可以置换出硫酸铜溶液中的铜 | |
| B. | 铁制容器盛放和运输浓硫酸 | |
| C. | 明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物.可用于水的净化 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如下表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com