
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:
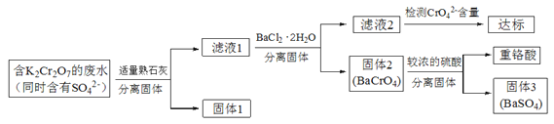
已知:i. CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 |
|
|
|
|
ii. Cr2O72-+ H2O![]() 2 CrO42-+ 2H+
2 CrO42-+ 2H+
(1)向滤液1中加入BaCl2·H2O的目的,是使CrO42-从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用是_______________________________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由是________________。
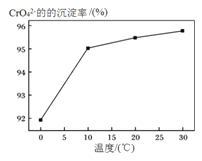
③研究温度对CrO42-沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下CrO42-的沉淀率![]() ,
,
如下图所示。
已知:BaCrO4(s) ![]() Ba2+ (aq) + CrO42-(aq)
Ba2+ (aq) + CrO42-(aq)
CrO42-的沉淀效率随温度变化的原因是___________________________________。
(2)向固体2中加入硫酸,回收重铬酸。
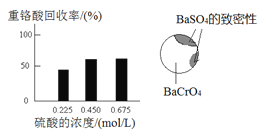
① 硫酸浓度对重铬酸的回收率如下图(左)所示。结合化学平衡移动原理,解释使用0.450 mol/L的硫酸时,重铬酸的回收率明显高于使用0.225 mol/L的硫酸的原因是_________________________________。
② 回收重铬酸的原理如下图(右)所示。当硫酸浓度高于0.450 mol/L时,重铬酸的回收率没有明显变化,其原因是_______________________________。
(3)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与___________有关。
【答案】沉淀SO42-;调节溶液pH,使Cr2O72-转化为CrO42-而沉淀BaCrO4比CaCrO4更难溶,可以使CrO42-沉淀更完全温度升高,沉淀速率加快c(H2SO4)增大,则c(SO42-)增大,与Ba2+生成沉淀,促进BaCrO4![]() Ba2++CrO42-平衡右移,c(CrO42-)增大;同时,c(H+)也增大,共同促进Cr2O72-+H2O
Ba2++CrO42-平衡右移,c(CrO42-)增大;同时,c(H+)也增大,共同促进Cr2O72-+H2O![]() 2CrO42-+2H+平衡左移,有利于生成更多的H2Cr2O7BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4
2CrO42-+2H+平衡左移,有利于生成更多的H2Cr2O7BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4
外,使其难于接触H2SO4,阻碍重铬酸生成受到溶液pH 、温度、H2SO4浓度、BaCrO4颗粒大小等影响(其他答案合理给分)
【解析】
①加入熟石灰有两个作用,首先Ca2+使SO42-沉淀便于分离,同时OH-的加入会与溶液中的H+反应,使上述离子方程式平衡向右移动,Cr2O72-转化为CrO42-,便于与BaCl2·H2O生成沉淀BaCrO4。
②BaCrO4的溶度积比CaCrO4小很多,所以BaCrO4更难溶,加入Ba2+可以使CrO42-沉淀更完全。
③根据热化学方程式可知沉淀溶解是吸热反应,因此生成沉淀的过程是放热的,温度升高会加快生成沉淀的速率,在未达化学平衡态时,相同的时间间隔内产生更多的沉淀,所以沉淀率提高。
(3)①c(H2SO4)增大,则c(SO42-)增大,与Ba2+生成沉淀,促进BaCrO4![]() Ba2++CrO42-平衡右移,c(CrO42-)增大;同时,c(H+)也增大,共同促进Cr2O72-+H2O
Ba2++CrO42-平衡右移,c(CrO42-)增大;同时,c(H+)也增大,共同促进Cr2O72-+H2O![]() 2CrO42-+2H+平衡左移,有利于生成更多的H2Cr2O7。
2CrO42-+2H+平衡左移,有利于生成更多的H2Cr2O7。
②BaSO4与BaCrO4溶解度接近,c(H2SO4)越大,越有利于生成BaSO4,包裹在BaCrO4外,使CrO42-更难接触到H2SO4,阻碍H2Cr2O7生成,所以H2SO4浓度高于0.450mol/L时,H2Cr2O7的回收率没有明显变化。
(3)溶液pH降低有利于生成Cr2O72-,温度改变会影响沉淀回收率,加入H2SO4能回收H2Cr2O7,同时BaCrO4颗粒大小关系到回收量的多少,颗粒越大BaSO4越难完全包裹住BaCrO4,因此沉淀BaCrO4并进一步回收H2Cr2O7的效果受溶液pH、温度、H2SO4浓度、BaCrO4颗粒大小等影响。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
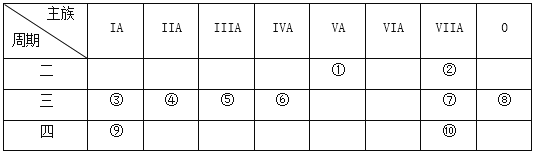
(1)在③~⑦中元素,原子半径最大的是_____________,其离子的结构示意图是__________________。
(2)表中的①~⑩中元素,非金属性最强的是_______,化学性质最稳定的是________,金属性最强的是__________,最高价氧化物的水化物的酸性最强的是(写该水化物的化学式)______________。
(3)⑦的氢化物的水溶液与①的氢化物的水溶液反应的离子方程式为___________________________。
(4)用一个化学反应说明⑦比⑩的单质化学性质活泼,写出反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4在水中不稳定,发生反应:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是
4Fe(OH)3(胶体)+8OH-+3O2,其稳定性与温度(T)和溶液pH的关系分别如图所示。下列说法不正确的是

A. 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱
B. 由图Ⅱ可知图中a>c
C. 由图Ⅰ可知温度:T1>T2>T3
D. 由图Ⅰ可知上述反应△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,H2(g)+CO2(g)![]() H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v(H2O)为0.025 mol/(L·min),下列判断不正确的是()
起始浓度 | 甲 | 乙 | 丙 |
C(H2)/mol/L | 0.1 | 0.2 | 0.2 |
C(CO2)/mol/L | 0.1 | 0.1 | 0.2 |
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计实验探究SO2的性质。
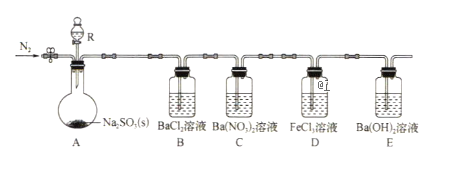
实验现象:B中无沉淀生成,C中有白色沉淀,D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是__________.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:__________.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2"的目的是____.
(4)探究装置C中通人SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通人过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4+2SO42-+2NO+4H+
猜想2:通入少量的SO2,则发生反应的离子方程式为__________。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中, __________ | __________ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是(填字母)(_____)
A.KSCN溶液 B.NaOH溶液 C.K3[Fe(CN)6]溶液 D.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适量M于试管中,滴少量盐酸(M剩余),所得溶液的pH__________7(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)氯碱工业中电解饱和食盐水流程及原理示意图如下图所示。
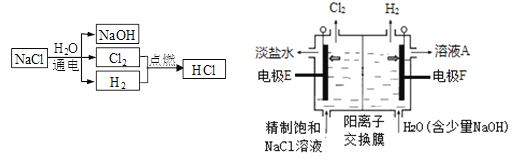
(1)生成H2的电极反应式是_________________________________________。
(2)Na+向________(填“E”或“F”)方向移动,溶液A的溶质是______________。
(3)电解饱和食盐水总反应的离子方程式是_____________________________。
(4)常温下,将氯碱工业的附属产品盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液pH |
① | 0.1 | 0.1 | pH=5 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH>7 |
ⅰ. 实验①中所得混合溶液,由水电离出的c(H+)=______ mol·L-1。
ⅱ. 实验②中,c______0.2(填“>”“<”或“=”)。
ⅲ. 实验③中所得混合溶液,各离子浓度由大到小的顺序是__________________。
ⅳ. 实验①、③所用氨水中的![]() :①___________③(填“>”“<”或“=”)。
:①___________③(填“>”“<”或“=”)。
(5)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中的Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。

下列表述正确的是_______。
A. 氯处理饮用水时,在夏季的杀菌效果比在冬季好
B. 在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C. 用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时效果差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.H+、Na+、HCO3-、NO3-B.Ag+、NO3-、Cl-、Na+
C.Na+、Mg2+、SO42-、Cl-D.Na+、H+、OH-、ClO—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:

回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com