
 .第一电离能最小的元素是Cu(填元素符号).
.第一电离能最小的元素是Cu(填元素符号).
分析 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为铜元素;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为氯元素.
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,结合泡利原理、洪特规则画出其轨道排布图;
四种元素中只有Cu为金属,其它为非金属,金属的电离能最小;
(2)HF分子间存在氢键,沸点最高,其它卤化氢随着相对分子质量递增,其沸点升高;
(3)图一为平面结构,在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
根据均摊法计算晶胞中C原子数目,进而计算晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度;
(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键.
解答 解:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的基态原子的最外能层只有一个电子,其他能层均已充满电子,D原子外围电子排布为3d104s1,则D为铜元素;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则B为氯元素,
(1)四种元素中电负性最大的是Cl,其基态原子的价电子排布为3s23p5,其基态原子的价电子排布图为 ,四种元素中只有Cu为金属,其它为非金属,Cu的第一电离能最小;
,四种元素中只有Cu为金属,其它为非金属,Cu的第一电离能最小;
故答案为: ;Cu;
;Cu;
(2)HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高,即沸点由高到低的顺序是HF>HI>HBr>HCl,
故答案为:HF>HI>HBr>HCl;HF分子之间形成氢键,使其熔沸点较高,HI、HBr、HCl分子之间只有范德华力,相对分子质量越大,范德华力越大,沸点越高;
(3)图一为平面结构,在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化;
一个晶胞中含碳原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$+4=8,晶胞质量为$\frac{8×12}{{N}_{A}}$g,晶胞密度=(8×$\frac{12}{6.02×1{0}^{23}}$g)÷(356.6×10-10cm)3≈3.5 g•cm-3,
故答案为:sp2;3.5;
(4)晶体Cu为面心立方最密堆积,结合图三醋酸铜晶体的局部结构可确定其晶体中含有极性键、非极性键和配位键,
故答案为:面心立方最密堆积;①②③.
点评 本题是对物质结构的考查,题目综合性较大,涉及元素推断、核外电子排布、电离能、晶体结构与化学键、晶胞计算等,是对学生综合能力的考查,需要学生具备一定的数学计算能力,注意涉及中学常见晶胞结构,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属铝投入NaOH溶液中:2Al+2OH-+H2O═2AlO2-+2H2↑ | |
| B. | 石英与烧碱反应:SiO2+2OH-═SiO32-+H2O | |
| C. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 向小苏打溶液中加入过量Ba(OH)2:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
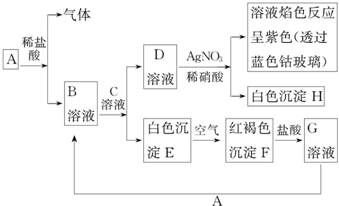
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4滴入NaAlO2溶液中 | B. | Ba(OH)2溶液滴入Al2(SO4)3溶液中 | ||
| C. | Al2(SO4)3溶液滴入NaOH溶液中 | D. | 氨水滴入Al2(SO4)3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、Cl-、NO3- | B. | Al3+、Mg2+、SO42-、OH- | ||
| C. | Fe2+、H+、K+、MnO4- | D. | Cu2+、H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分液.
分液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基丁烷 | B. | 2-甲基-5-乙基-1-己烷 | ||
| C. | 3-甲基-2-丁烯 | D. | 3,3-二甲基-2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
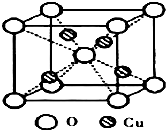 铜是过渡元素.化合物中,铜常呈现+1价或+2价.
铜是过渡元素.化合物中,铜常呈现+1价或+2价. ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com