
工业废水中常含有一定量的Cr2O72﹣和CrO42﹣,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原沉淀法处理,该法的工艺流程为:CrO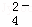
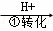 CrO
CrO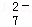
 Cr3+
Cr3+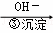 Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显 色.
(2)能说明第①步反应达平衡状态的是 .
a.Cr2O72﹣的浓度不变 b.Cr2O72﹣和CrO42﹣的浓度相同c.2v(Cr2O72﹣)=v(CrO42﹣)d.溶液的颜色不变
(3)第②步反应中,还原剂为 .
(4)电镀废液中Cr2O72﹣还可通过下列反应转化:
Cr2O72﹣(aq)+2Pb2+(aq)+H2O(l)⇌2PbCrO4(s)+2H+(aq)△H<0
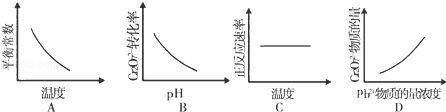
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是A
(5)泡沫灭火器中所用的原料是小苏打(NaHCO3)和硫酸铝,写出泡沫灭火器中当两者混合时发生反应的离子方程式 .
(6)已知NaHSO3溶液显酸性,其原因是 (用离子方程式和相关语言说明)
考点: 化学平衡状态的判断;化学平衡的影响因素;盐类水解的应用.
分析: (1)根据浓度对化学平衡移动的影响知识来回答;
(2)根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)化合价升高为还原剂;
(4)根据升高温度反应速率加快,平衡逆向移动,pH越大,平衡正向移动,Pb2+的浓度越大,平衡正向移动,结合图象分析;
(5)泡沫灭火器中铝离子和碳酸氢根离子在水溶液中发生双水解反应,生成氢氧化铝沉淀和二氧化碳气体;
(6)依据弱酸酸式根在溶液中既能水解又能电离分析.
解答: 解:(1)若平衡体系的pH=12,在碱性环境下,化学平衡2CrO42﹣(黄色)+2H+⇌Cr2O72﹣(橙色)+H2O逆向移动,溶液显示黄色,故答案为:黄;
(2)a.Cr2O72﹣的浓度不变,说明达到平衡,故a正确;
b.Cr2O72﹣和CrO42﹣的浓度相同,不一定平衡,故b错误;
c.2v正(Cr2O72﹣)=v逆(CrO42﹣)是平衡状态,故c错误;
d.溶液的颜色不变,证明各组分的浓度不随时间的变化而变化,故d正确;故选ad;
(3)化合价升高,是氧化还原反应中的还原剂,在第②步反应中,亚铁离子化合价升高,为还原剂,Cr元素的化合价降低,为氧化剂,故答案为:Fe2+;
(4)A.升高温度平衡逆向移动,化学平衡常数减小,与图象一致,故A正确;
B.pH越大,平衡正向移动的趋势越大,Cr2O72﹣转化率增大,与图象不符,故B错误;
C.升高温度,反应速率增大,与图象不符,故C错误;
D.Pb2+的浓度越大,平衡正向移动,Cr2O72﹣的物质的量越小,与图象不符,故D错误;故答案为:A;
(5)泡沫灭火器中铝离子和碳酸氢根离子在水溶液中发生双水解反应,生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为:Al3++3HCO3﹣=Al(OH)3↓+3CO2↑;故答案为:Al3++3HCO3﹣=Al(OH)3↓+3CO2↑;
(6)NaHSO3溶液中既存在HSO3﹣的水解(HSO3﹣+H2O⇌H2SO3+OH﹣),水解导致溶液呈碱性,也存在HSO3﹣的电离(HSO3﹣⇌H++SO32﹣),电离导致溶液呈酸性,由于亚硫酸氢钠溶液呈酸性,故亚硫酸氢根的电离程度大于水解程度,故答案为:NaHSO3溶液中既存在HSO3﹣的水解(HSO3﹣+H2O⇌H2SO3+OH﹣),也存在HSO3﹣的电离(HSO3﹣⇌H++SO32﹣),电离程度大于水解程度,所以NaHSO3溶液显酸性.
点评: 本题涉及化学平衡状态的判断、化学平衡的移动等方面的知识,注意知识的梳理和归纳是解题的关键,难度不大.


科目:高中化学 来源: 题型:
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)⇌2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量).下列判断正确的是()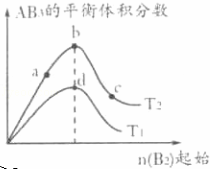
A. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为b>a>c
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,一定浓度的某溶液,由水电离出的c(OH﹣﹣)=10﹣﹣4mol/L,则该溶液中的溶质可能是()
A. Na2SO4 B. CH3COOH C. NaOH D. CH3COOK
查看答案和解析>>
科目:高中化学 来源: 题型:
下列方程式书写正确的是()
A. 碳酸的电离方程式:H2CO3⇌2H++CO32﹣
B. 向氯化钙溶液中通入二氧化硫气体:Ca2++SO2+H2O=CaSO3↓+2H+
C. 往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+S2﹣(aq)=Ag2S(s)
D. 明矾水解:Al3++3H2O⇌Al(OH)3+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物X催化氧化的产物是(CH3)2CHCHO,有机物X是( )
A. 乙醇的同系物 B. 乙醛的同系物
C. 丙醇的同分异构体 D. 丙醛的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2﹣和C﹣,B2+和C﹣具有相同的电子层结构,下列说法正确的是( )
A. C元素的最高正价为+7价 B. 原子半径:A>B>C
C. 离子半径:A2﹣>C﹣>B2+ D. 还原性:A2﹣<C﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
A元素得电子变成阴离子时放出的能量比B元素得电子成阴离子时放出的能量大,那么下列判断正确的是()
A. 氧化性A﹣>B﹣ B. 还原性A﹣>B﹣ C. 氧化性A>B D. 还原性A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
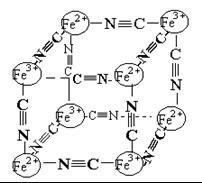
分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:MxFey(CN)z,研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子结构如图示,下列说法正确的是( )
A.该晶体是原子晶体
B.M的离子位于上述立方体的面心,呈+2价
C.M的离子位于上述立方体的体心,呈+1价,且M+空缺率(体心中没有M+的占总体心的百分比)为50%
D.晶体的化学式可表示为MFe2(CN)3,且M为+1价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com