
【题目】下列变化中,不存在化学键断裂的是( )
A.氯化氢气体溶于水
B.干冰气化
C.氯化钠固体溶于水
D.氢气在氯气中燃烧
科目:高中化学 来源: 题型:
【题目】清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O22NaNO2
②酸性条件下,NO或NO2都能与KMnO4溶液反应生成NO3- 。
回答下列问题:
(1)仪器a名称:________。
(2)B瓶内装的物质是:____。
(3)若NO能被Na2O2完全吸收,E装置中的现象为___________________________。
(4)三颈烧瓶A中反应的化学方程式为_____________________________。
(5)C装置的作用是_____________________________________。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)现有已制得SO2的饱和溶液,请设计一个简单实验,比较SO2与Fe2+ 还原性的
强弱(可供选择的试剂有:SO2的饱和溶液、FeCl2溶液、氯水、FeCl3溶液、KSCN
溶液、Ba(NO3)2溶液、BaCl2溶液)【要求:简要写出实验步骤、现象和结论】_________________________________________________________________。
(7)某同学测定部分变质的Na2SO3样品样品中Na2SO3的含量(已知在酸性条件下IO3-能将SO32-氧化为SO42-,自身还原为I-):
①用电子天平称取16.00g Na2SO3固体配成l00 mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000 mol L-1酸性KIO3溶液(硫酸酸化)滴定,三次平行实验测得标准液的体积为24.00mL。则滴定终点时锥形瓶中产生的现象为________________________,写出与产生终点现象有关反应的离子方程式________________________________,样品中Na2SO3的质量分数为_________。(计算结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是
A | B | C | D |
千淘万漉虽辛苦,吹尽黄沙始到金。刘禹锡《浪淘沙》诗句 |
司母戊鼎 |
侯德榜 |
瓷器(China) |
诗句中“淘”“漉”相当于分离提纯操作中的“过滤”。 | 属青铜制品,是我国古代科技光辉成就的代表之一。 | 我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱。 | 属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
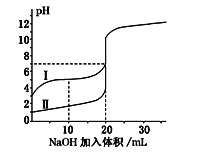
A. Ⅰ表示的是滴定盐酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C. V(NaOH)=20mL时,两份溶液中c(Cl-)=c(CH3COO-)
D. V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面说法中,与盐类水解无关的是( )
①NaHCO3做发酵粉时加入柠檬酸后效果更好
②FeCl2溶液中加入一定量的铁粉
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4F溶液不能保存在玻璃试剂瓶中
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧室温下NaHCO3饱和溶液pH约为8.4
⑨0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L
A. ②⑧ B. ①② C. ④⑧ D. 全有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是当前应用最广泛的金属材料之一,铝制品及其化合物在日常生活和工农业生产中也有着重要的用途。回答下列问题:
(1)基态铝原子的核外电子排布式为____________。
(2)根据元素周期律等知识判断,第一电离能Al____________Mg(填写“大于”或“小于”)。
(3)Al2O3是常用的耐火材料,工业上也是用电解Al2O3方法制取金属Al,据此判断Al2O3的晶体类型是____________。
(4)LiAlH4是一种重要的有机合成试剂,AlH4-的立体构型为____________,LiAlH4中Al原子的杂化轨道类型为____________。
(5)金属铝的晶胞结构如图1所示,原子之间相对位置关系的平面图如图2所示。
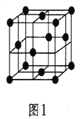
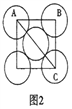
①晶体铝中原子的堆积方式为____________。
②已知铝原子半径为acm,摩尔质量为Mg·mol-1,阿伏加德罗常数的值为NA,则晶体铝的密度ρ=_______g·cm-3(用含a、M、NA的代数式来表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,B和X均可与A形成10电子的化合物;B与Z的最外层电子数之比为2:3,化合物Y2X2与水反应生成X的单质,所得溶液可使酚酞变红。请回答下列问题。
(1)Z的原子结构示意图为_______,化合物BA4的电子式为__________。
(2)化合物Y2X2中含有的化学键类型有________________________。
(3)化合物A2X和A2Z中,沸点较高的是_________(填化学式),其主要原因是______。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上通常把原子数和电子数相等的分子或离子称为等电子体,人们发现等电子体间的结构和性质相似(即等电子原理),B3N3H6被称为无机苯,它与苯是等电子体,则下列说法中不正确的是
A. 无机苯是由极性键组成的非极性分子
B. 无机苯能发生加成反应和取代反应
C. 无机苯不能使KMnO4酸性溶液褪色
D. 无机苯的二氯取代物有3种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com