
| A. | 在100ml 1mol•L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100ml 2mol•L-1的FeI2的溶液中通入标况下5.6L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O |
分析 A.二氧化硫足量,硝酸根离子在酸性条件下具有强氧化性,能够氧化二氧化硫;
B.100ml 2mol•L-1的FeI2的溶液中含有碘化亚铁的物质的量为0.2mol,标准状况下5.6L氯气的物质的量为0.25mol,0.2mol碘化亚铁完全反应消耗0.3mol氯气,说明氯气不足,碘离子优先被氧化,剩余的氯气再氧化亚铁离子;
C.氢氧化钙过量,反应后不会有碳酸根离子;
D.氢氧化钠过量,反应生成偏铝酸钠和水.
解答 解:A.在100ml 1mol•L-1的Fe(NO3)3的溶液中通入足量SO2,硝酸根离子也参与反应,正确的离子方程式为:Fe3++5SO2+4H2O+3NO3-=3NO↑+Fe2++5SO42-+8H+,故A错误;
B.在100mL 2mol•L-1的FeI2的溶液中通入标况下5.6L的Cl2,碘化亚铁的物质的量为:2mol/L×0.1L=0.2mol,标准状况下5.6L氯气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,0.2mol FeI2完全反应消耗氯气的物质的量为:0.2mol×($\frac{1}{2}$+1)=0.3mol,氯气不足,碘离子优先反应,0.4mol碘离子完全反应消耗0.2mol氯气,剩余的0.5mol氯气能够氧化0.1mol亚铁离子,则正确的离子方程式为:2Fe2++8I-+5Cl2═2Fe3++4I2+10Cl-,故B错误;
C.向NaHCO3溶液中加入过量的澄清石灰水,反应生成碳酸钙沉淀、氢氧化钠和水,正确的离子方程式为:HCO3-+Ca2++OH-═CaCO3↓+H2O,故C错误;
D.AlCl3溶液中加入过量的NaOH溶液,反应的离子方程式为:Al3++4OH-═AlO2-+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的判断,题目难度中等,明确离子方程式的书写原则为解答关键,A、B为易错点,注意硝酸根离子在酸性条件下具有强氧化性,碘离子的还原性大于亚铁离子,氯气不足时碘离子优先反应,试题侧重考查学生的分析、理解能力及灵活应用能力.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
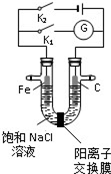
| A. | K1闭合,铁棒侧溶液会出现白色沉淀,而且沉淀最终变为红褐色 | |
| B. | K1或 K2闭合,石墨棒周围溶液 pH 均升高 | |
| C. | K2闭合,铁棒上发生的反应为 2Cl--2e-═Cl2↑ | |
| D. | K2闭合,电路中通过 0.002NA个电子时,两极共产生 0.002mol 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何酸、碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富,仅次于铁 | |
| D. | 工业上通常用钠与铝盐溶液反应来制备铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+H2O═H2CO3化合反应 | |
| B. | Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O 分解反应 | |
| C. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2置换反应 | |
| D. | NaCl+AgNO3═AgCl↓+NaNO3复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被玻璃割伤手后,先取出伤口里的玻璃片,再用稀过氧化氢溶液擦洗,然后敷药包扎 | |
| B. | 制取蒸馏水时,为了防止瓶内产生暴沸现象,应向烧瓶内加入几片碎瓷片 | |
| C. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 | |
| D. | 滴瓶中的滴管用后不用清洗,直接放到原滴瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6a g | B. | (a-1.6)g | C. | (a-3.2)g | D. | (2a-3.2)g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下干燥氯气与铁不反应,可以用钢瓶储存氯水 | |
| B. | 二氧化硫具有漂白、杀菌性能,可在食品生产中大量使用 | |
| C. | 浓硫酸具有吸水性,可以用来干燥氨气 | |
| D. | 次氯酸钠具有强氧化性,可用于配制消毒液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com