
| A. | 漂白粉漂白物质时发生的发应和变质失效时的反应一样 | |
| B. | 将氯气溶于水中,当水中各成分浓度保持不变时,即表示反应停止 | |
| C. | 二氧化硅固体是由原子直接构成的,那么固态二氧化碳也是由原子直接构成 | |
| D. | 碱金属(如钾、钠等)可以存放在所有有机溶剂中,而白磷则应保存在水中 |
分析 A.氯气与Ca(OH)2反应制备漂白粉,漂白粉漂白时生成HClO,漂白粉在空气中久置失效也生成HClO,以此来解答;
B.氯水中存在溶解平衡,达到平衡状态时,各组分浓度不变,不是反应停止;
C.二氧化硅为原子晶体,而二氧化碳为分子晶体;
D.碱金属性质活泼,能够与羧酸、醇类发生反应.
解答 解:A.氯气与氢氧化钙反应制备漂白粉,则漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分为Ca(ClO)2,工业上制取漂白粉的化学方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,用漂白粉漂白时,发生Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,漂白粉久置空气中失效的原理为Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO,即反应原理相同,故A正确;
B.将氯气溶于水中,当水中各成分浓度保持不变时,达到溶解平衡,但是反应没有停止,故B错误;
C.二氧化硅固体属于分子晶体,属于二氧化硅是由原子直接构成的,而二氧化碳形成的晶体为分子晶体,二氧化碳是有分子构成的,故C错误;
D.碱金属(如钾、钠等)化学性质比较活泼,能够与醇、羧酸等有机物反应,所以不可能存放在所有有机溶剂中,故D错误;
故选A.
点评 本题考查较为综合,涉及漂白粉性质、溶解平衡及其影响、原子晶体与分子晶体特点、化学试剂的保存等知识,题目难度中等,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定是非自发的化学反应,放热反应不需要加热就能发生反应 | |
| B. | 其它条件不变时,增大压强可以增大活化分子百分数,使化学反应速率加快 | |
| C. | 温度、压强一定时,熵增加的反应都能自发进行 | |
| D. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a和b可形成气态化合物 | |
| B. | c的原子半径小于d的原子半径 | |
| C. | b和c形成的化合物为离子化合物 | |
| D. | a和d最高价氧化物的水化物均呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅦA族的最大 | |
| B. | 同主族两种元素原子的核外电子数的差值可能为36 | |
| C. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素的原子 | |
| D. | 科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01mol•L-1的H2SO4溶液 | B. | 0.01mol•L-1的Ba(OH)2溶液 | ||
| C. | c(OH-)=1×10-11mol•L-1的溶液 | D. | c(H+)=1×10-12mol•L-1的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
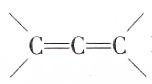 不稳定).
不稳定).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合:c(OH-)+c(M+)=c(H+)+c(A-) | |
| B. | 将物质的量浓度均为0.1mol•L-1的Na2CO3溶液和NaHCO3溶液等体积混合所得溶液中:2c(OH-)-2c(H+)=3c(H2CO3)+c(HCO${\;}_{3}^{-}$)-c(CO${\;}_{3}^{2-}$) | |
| C. | 等浓度、等体枳的Na2CO3和NaHCO3混合:$\frac{c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$<$\frac{c(C{O}_{3}^{2-})}{c(HC{O}_{3}^{-})}$ | |
| D. | 将足量AgCl分别放入:①5mL水,②10mL0.2mol/LMgCl2,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com