
(1)浓硫酸与木炭粉加热反应的化学方程式为: 。
(2)试用下图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编号): → → → 。

(3)实验时可观察到装置①中,A瓶的溶液褪色,C瓶的溶液不褪色。
A瓶溶液的作用是: ,
B瓶溶液的作用是 ,
C瓶溶液的作用是 。
(4)装置②中所加的白色固体药品是 ,可验证的产物是 。
(5)装置③中所盛的溶液是 ,可验证的产物是 。
(6)在各装置所盛的试剂不变的条件下,若装置的连接顺序为④→①→②→③,则可以检出的产物是 (填化学式,下同),不能检出的产物是 。
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源:2015-2016学年河北省高二上二调考试化学试卷(解析版) 题型:选择题
0.1mol/LNaHCO3的溶液的pH最接近于( )
A.5.6 B.7.0 C.8.4 D.13.0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆市高一上期中测试化学试卷(解析版) 题型:填空题
(并非只有得氧、失氧的反应才是氧化还原反应,凡是有元素化合价升降的化学反应都是氧化还原反应。现在如下氧化还原反应,回答下列问题:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)氧化剂是_________,氧化产物是________
(2)未变价元素是_______,将反应成离子方程式________
(3)用单线桥表示转移的电子数:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)氧化产物和还原产物的质量之比为___________________
(5)反应中生成3.6gH2O,转移电子数为_______个。
(6)已知铵盐受热易分解,硝酸铵在一定条件下发生的分解反应为:5NH4NO3=2HNO3+4N2↑+9H2O,当生成还原产物0.6mol时,转移的电子的物质的量是_________mol。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次段考化学试卷(解析版) 题型:选择题
列各项中,表达正确的是( )
A.乙烯的结构简式:C2H4 B. F原子结构示意图: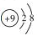
C.NH3的结构式: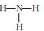 D.HCl的电子式:
D.HCl的电子式: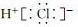
查看答案和解析>>
科目:高中化学 来源:2016届吉林长春外国语学校高三上第一次质检化学试卷(解析版) 题型:填空题
(1)如图所示为硝酸铜晶体[Cu(NO3)2·nH2O]的溶解度曲线(温度在30 ℃前后对应不同的晶体),从图中获取如下信息,不正确的有 (填字母)。

a.C点溶液为Cu(NO3)2的不饱和溶液
b.30℃时结晶可析出两种晶体
c.按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.将A点溶液升温至30 ℃时,可以析出
Cu(NO3)2·3H2O晶体
(2)某些共价化合物(如H2O、NH3、N2O4等)在液态时发生了微弱的电离,如:
2H2O OH-+H3O+,则液态NH3电离的方程式是
OH-+H3O+,则液态NH3电离的方程式是
(3)氢是未来最好的能源选择,制取氢气的成熟的方法有很多,利用甲醇可以与水蒸气反应生成氢气,反应方程式如下:
CH3OH(g) + H2O(g) CO2(g) + 3H2(g)
CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol
H(298K)=+ 49.4 kJ/mol
该条件下反应达平衡状态的依据是(填序号) 。
A.v正(CH3OH)=v正(CO2)
B.混合气体的密度不变
C.c(CH3OH)=c(H2O)
D.混合气体的总物质的量不变
(4) 甲、乙两容器体积相等,甲容器通入1 mol SO2和1 mol O2,乙容器通入1 mol SO3和0.5 mol O2,发生反应:2SO2(g) + O2 (g)  2SO3(g)
2SO3(g)  H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
H<0,甲、乙起始反应温度相同,均和外界无热量交换,平衡时,甲中SO2的转化率为a,乙中SO3的分解率为b,则a、b的关系为a+b 1(填“﹤”、“﹥”或“=”) 。
(5)甲醇是燃料电池的常见原料,现以熔融的K2CO3为电解质,以甲醇为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。下图是甲醇燃料电池模型,试回答下列问题:

①写出该燃料电池的负极反应式 。
②空气应该从 (选a、b、c、d)通入。 M、N是阴离子交换膜,则阴离子移动的方向是 (填“从左到右”或“从右到左”)
(6)含Al3+的盐常用作净水剂,用离子方程式表示其净水原理_________。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
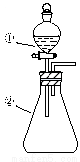
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
D | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西师范大学附属中学高三第一次模拟理化学试卷(解析版) 题型:推断题
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
②W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)x晶体属于 (填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
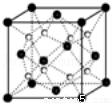
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含ρ、NA的计算式表示)
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中测试化学试卷(解析版) 题型:选择题
莫尔盐[(NH4)2Fe(SO4)2·8H2O]溶液经常用于定量滴定实验。下列有关说法正确的是
A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克
B.可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存
C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓
D.取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德石门第一中学高二上期中文化学卷(解析版) 题型:填空题
糖类和蛋白质是重要的营养物质,请回答:
(1)葡萄糖的分子式是 ,葡 萄糖是一种重要的 (填“单”或“多”)糖,他是一种重要的营养物质,在人体组织中进行氧化分解, (填“放出”或“吸收”)能量。
萄糖是一种重要的 (填“单”或“多”)糖,他是一种重要的营养物质,在人体组织中进行氧化分解, (填“放出”或“吸收”)能量。
(2)淀粉水解的最终产物是 ,蛋白质水解的最终产物是 ,提纯蛋白质可以采用的一种方法是 (填“盐析”或“过滤”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com