
| A. | 甲烷 | B. | 甲醛 | C. | 醋酸 | D. | 二氧化硫 |
分析 甲醛能使蛋白质失去原有的生理活性而变性,一些装饰材料、胶合板、涂料等会不同程度地释放出甲醛气体,而使室内空气中甲醛含量超标,成为室内空气污染的主要原因之一.
解答 解:A.甲烷为天然气的主要成分,为化石燃料之一,装饰材料、胶合板、涂料等不含有该气体,故A错误;
B.有些装饰材料、胶合板、涂料等中添加的甲醛的不同程度地挥发,而使室内空气中甲醛含量超标,导致室内空气污染,故B正确;
C.醋酸是有刺激性气味的液体,但装饰材料、胶合板、涂料等不含有该气体,故C错误;
D.二氧化硫是有刺激性气味的有毒气体,能引起酸雨的形成,但装饰材料、胶合板、涂料等不含有该气体,故D错误;
故选B.
点评 本题考查常见的生活环境的污染及治理,难度不大,化学来源于生活又服务于生活,但是在使用化学物质时要合理的使用,防止对环境造成污染、对人体造成伤害.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 乙炔先加一分子HCl,再加H2(氯乙烷) | |
| C. | Cl2和苯用FeCl3作催化剂(氯苯) | |
| D. | 等物质的量的Cl2和C2H6在光照条件下(氯乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ③ | C. | ①⑤②⑥ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
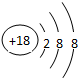 .元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.
.元素⑩名称为溴单质与水反应化学方程式Br2+H2O=HBr+HBrO.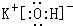 .
.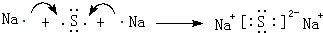 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.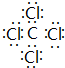 、
、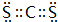 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
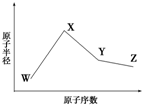 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的、半导体材料;Z原子得电子能力是同周期主族元素中最大的.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com