
| 0.3mol |
| 2 |
| 0.15mol |
| 0.2L |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
| A、4个 | B、5个 | C、6个 | D、7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
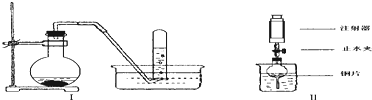
查看答案和解析>>
科目:高中化学 来源: 题型:
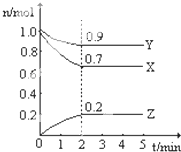 I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式/ | 催化效果/g?g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
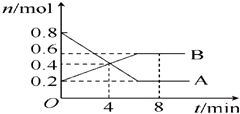
查看答案和解析>>
科目:高中化学 来源: 题型:
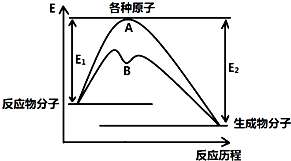 已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
已知某反应在不同条件下的反应历程可以表示成如图所示,E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:| 化学键 | H-H | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ?mol-1) | 436 | 247 | x | 463 | 431 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氧化 |
| 银氨溶液 |
| H+ |
| CH3OH/H+ |
| △ |
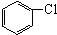 与
与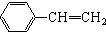 也可以发生类似反应①的反应,其有机产物的结构简式为
也可以发生类似反应①的反应,其有机产物的结构简式为查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com