
| A. | 平衡常数与反应物或生成物的浓度变化无关,温度越高,平衡常数越大 | |
| B. | 25℃时,Mg(OH)2固体在同体积、同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者较小 | |
| C. | 25℃时NH4Cl溶液中的Kw大于100℃时NaCl溶液中的Kw | |
| D. | 2S℃时,H2SO3溶液的一级电离常数为Ka,则NaHSO3溶液的水解常数Kb=$\frac{Kw}{Ka}$ |
分析 A、平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
B、Ksp只与温度有关;
C、水的离子积常数随温度的升高而增大;
D、根据Ka=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,Kb=$\frac{[{H}_{2}S{O}_{3}]•[{H}^{+}]}{[HS{{O}_{3}}^{-}]}$分析.
解答 解:A、.如果正反应是吸热反应,温度越高,平衡越向正反应方向移动,则K值越大,如果正反应是放热反应,温度越高,平衡越向逆反应方向移动,则K值越小,故A错误;
B、Ksp不随浓度变化,只与温度有关,所以Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,二者相同,故B错误;
C、温度越高水的离子积常数越大,故C错误;
D、Ka=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,Kb=$\frac{[{H}_{2}S{O}_{3}]•[O{H}^{-}]}{[HS{{O}_{3}}^{-}]}$,所以Ka×Kb=KW,故D正确;
故选D.
点评 明确化学平衡K的含义是解本题关键,知道K值大小的影响因素,知道所有的平衡常数只与温度有关,与物质的浓度无关,化学平衡常数表达式中不含固体和纯液体,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷是由碳、氢、氯三种元素组成的化合物 | |
| B. | 氯乙烷是由2个碳原子、5个氢原子和1个氯原子构成的 | |
| C. | 氯乙烷用于冷冻麻醉与其沸点较低,易挥发吸热有关 | |
| D. | 氯乙烷中碳、氢、氯三种元素的质量比为48:10:7l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图.| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
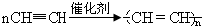 .
.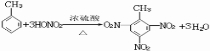 ;该物质的一氯代物有4种.
;该物质的一氯代物有4种.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
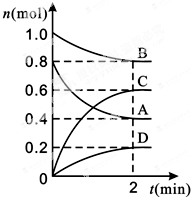 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示.已知:物质A、B、C均为气态、D为固态,正反应是吸热反应.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
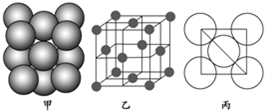
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com