
| A. | 18 g H2O所含的分子数为NA | |
| B. | 22.4 L H2O所含的分子数为NA | |
| C. | NA个氢原子的质量为2 g | |
| D. | 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl- |
分析 A.质量转化为物质的量,依据N=nNA计算;
B.气体摩尔体积使用对象为气体;
C.氢原子摩尔质量为1g/mol;
D.氯化钠为强电解质,完全电离.
解答 解:A.18 g H2O物质的量为$\frac{18g}{18g/mol}$=1mol,所含的分子数为NA,故A正确;
B.水标况下为液体,不能使用气体摩尔体积,故B错误;
C.NA个氢原子物质的量为1mol,质量为1 g,故C错误;
D.氯化钠为强电解质,1mol氯化钠含有1mol钠离子和1mol氯离子,1mol NaCl中含NA个Na+和NA个Cl-,故D错误;
故选:A.
点评 本题考查阿伏伽德罗常数的计算,明确物质的状态、质量、浓度、体积与物质的量的关系即可解答,难度不大.


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:推断题
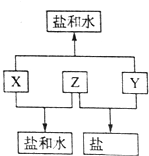 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.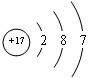 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=Q kJ•mol-1| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
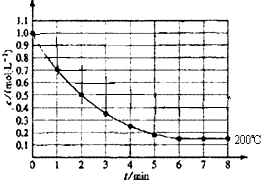 在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
在一密闭容器中放入1molX(g)发生反应:X(g)?4Y(g)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com