
| A. | 1L 1 mol•L-1盐酸中含有nA个HCl分子 | |
| B. | 32g O2与O3的混合物含有2nA个氧原子 | |
| C. | 1L 1 mol•L-1CuCl2溶液中含有nA个Cu2+ | |
| D. | 1mol Na与足量Cl2反应,转移2nA个电子 |
分析 A、氯化氢在水中电离出自由移动的阴阳离子;
B、32g O2与O3的混合物含有2nA个氧原子;
C、Cu2+是弱碱阳离子;
D、根据反应后钠元素的价态为+1价来分析.
解答 解:A、氯化氢溶于水时,在水分子的作用下,氯化氢完全电离出氢离和氯离子,所以盐酸溶液中不含氯化氢分子,故A错误;
B、32g氧气和臭氧的混合物中含有氧原子的质量为32g,含有的O原子的物质的量为2mol,含有的氧原子数为2nA,故B正确;
C、Cu2+是弱碱阳离子,在溶液中会水解,故Cu2+的个数小于nA个,故C错误;
D、反应后钠元素的价态为+1价,1mol钠反应后转移1mol电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
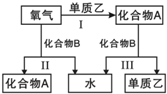 A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题:
A、B是中学化学常见的化合物,它们各由两种元素组成;乙为元素R组成的单质,它们之间存在如图所示关系.根据要求回答问题: ;其水溶液呈碱性的原因是NH3+H20
;其水溶液呈碱性的原因是NH3+H20 NH4++OH-(用离子方程式表示).
NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
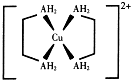 铜及其化合物在现代生活中应用广泛.
铜及其化合物在现代生活中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或H2SO4反应生成SeO2以回收Se.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 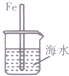 图中,插人海水中的铁棒,越靠近底端腐蚀越严重 | |
| B. | 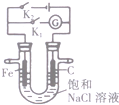 图中,闭合K2,铁电极的腐蚀速率比闭合K1时慢 | |
| C. | 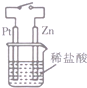 图中,接通开关时,Zn的腐蚀速率增大,Zn上放出气体的速率也增大 | |
| D. | 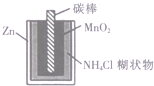 图中,锌锰电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
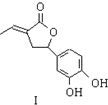 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$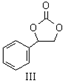
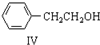 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$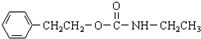 +H2O
+H2O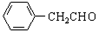 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热.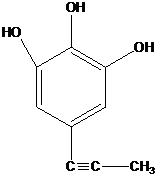 .
.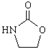 ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$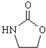 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期元素的离子半径从左到右逐渐减小 | |
| B. | 已知单质A能从溶液中置换出单质B,当A为非金属时,B也一定是非金属 | |
| C. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| D. | 同周期非金属元素氧化物对应水化物的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往鲜榨苹果汁中加入适量柠檬汁防止苹果汁变色 | |
| B. | 做馒头时加一些面碱(Na2CO3)避免馒头发酸 | |
| C. | 采用添加有“光触媒”的硅藻泥做装饰材料,净化室内空气,避免装修污染 | |
| D. | 用汽油洗掉衣物沾上的油渍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
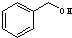 与
与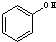 ⑥
⑥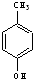 与
与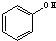
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com