
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
分析 12g石墨完全转化成金刚石时需要吸收a kJ的能量,说明石墨的能量低于金刚石的能量,石墨更稳定,金刚石的能量高,1mol石墨和金刚石完全燃烧时释放的能量金刚石比石墨多,并利用化合价来分析氧化还原反应.
解答 解:①石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,故①错误;
②石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,故②正确;
③12g石墨完全转化为金刚石时,要吸收a kJ的能量,金刚石的能量高,等质量的石墨和金刚石完全燃烧时释放的能量金刚石比石墨多,故③正确;
④C(石墨)═C(金刚石),碳元素的化合价在反应前后都是0,没有化合价的变化,则不属于氧化还原反应,故④错误.
所以正确的是②③.
故选B.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,注意能量低的物质更稳定即可解答,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案科目:高中化学 来源: 题型:解答题
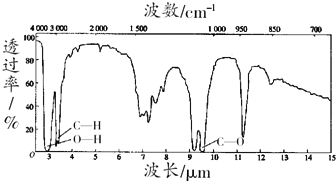
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物只有一种 | |
| B. | 气态氢化物稳定性:丙>丁 | |
| C. | 原子半径大小:戊<丙 | |
| D. | 丙的氧化物能与戊的氢化物的水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
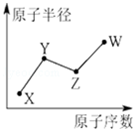 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: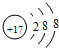 ;
;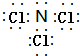 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若该反应的△H<0,升高温度,平衡常数K减小 | |
| B. | 若增大X的浓度,则物质Y的转化率减小 | |
| C. | 以X浓度变化表示的反应速率为$\frac{1}{8}$ mol/(L•s) | |
| D. | 12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的$\frac{1}{5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
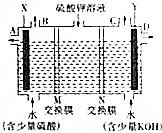
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 6 | C. | 8 | D. | 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有1个H-H键形成 | |
| B. | 1个N≡N键断裂的同时,有3个H-H键断裂 | |
| C. | 1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 1个N≡N键断裂的同时,有6个H-H键形成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com